题目内容
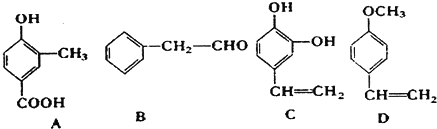
12.乙酸与某饱和一元醇完全反应后,生成的有机物的相对分子质量为乙酸的相对分子质量的1.7倍,则该醇可能为( )| A. | CH3OH | B. | CH3CH2OH | C. |  | D. |  |
分析 设饱和一元醇为CnH 2n+1OH,反应方程式为CH3COOH+CnH 2n+1OH→CH3COOCnH 2n+1+H2O,生成的有机物的相对分子质量为乙酸的相对分子质量的1.7倍,则有$\frac{14n+60}{60}=1.7$,计算n,可确定醇的种类.
解答 解:设饱和一元醇为CnH 2n+1OH,反应方程式为CH3COOH+CnH 2n+1OH→CH3COOCnH 2n+1+H2O,生成的有机物的相对分子质量为乙酸的相对分子质量的1.7倍,则有$\frac{14n+60}{60}=1.7$,n=3,应为丙醇,只有C符合,
故选C.
点评 本题考查有机物的计算,为高频考点,难度不大.明确饱和一元醇的通式及与酸反应的方程式的书写是解题的关键.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
2.下列生活或生产中的事实不能用化学反应速率的有关原理解释的是( )
| A. | 有些药物的标签上注明必须冷藏 | |
| B. | 铵态氮肥与草木灰不能同时施用 | |
| C. | 在接触室中加入五氧化二钒使二氧化硫与氧气在其表面反应 | |
| D. | 劈碎的木材燃烧更旺 |
20.食品添加剂通常必须在一定范围内使用,否则会损害人体健康,滥用下列食品添加剂会导致癌症发生率增加的是( )
| A. | KIO3 | B. | 苯甲酸钠 | C. | 维生素E | D. | NaNO2 |
7.分子式为C8H10O的苯的衍生物,其分子中含有两个互为对位的取代基,则其中不与NaOH 溶液反应的物质的种数为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
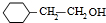 ;1molC最多能与3mol Br2发生反应.
;1molC最多能与3mol Br2发生反应.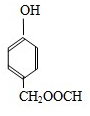 H
H .G和NaOH溶液反应的化学方程式为
.G和NaOH溶液反应的化学方程式为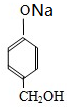 +HCOONa+H2O.
+HCOONa+H2O.
 ;
;