题目内容
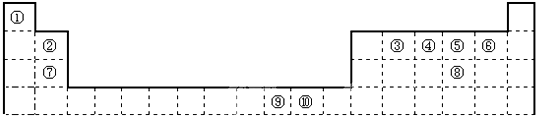
7.元素周期表揭示了许多元素的相似性和递变规律,同一周期构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或8的微粒,如下列周期表所示的一些分子或离子.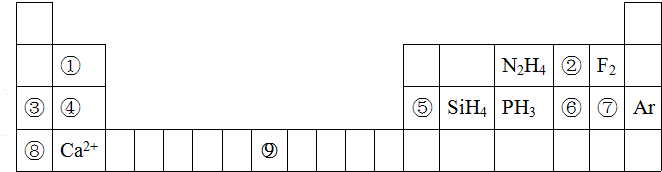
(1)写出⑨元素在元素周期表中的位置:第四周期第ⅤⅢ族;
(2)写出⑥、⑦、⑧三种元素简单离子半径由大到小的顺序为S2->Cl->K+;
(3)写出③、④、⑤、⑧四种元素的最高价氧化物的水化物的碱性强弱顺序:KOH>NaOH>Mg(OH)2>Al(OH)3;
(4)①元素和⑤元素的氢氧化物具有相似的化学性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5)用电子式表示④、⑦两种元素形成化合物的过程:
 ;
;(6)含有⑥元素某种18电子的离子与H+及OH-均可发生反应,分别写出反应的离子方程式:HS-+H+=H2S↑;HS-+OH-=S2-+H2O;
(7)②、③两种元素的单质在加热条件下发生反应生成的产物的化学式为Na2O2,其中所含的化学键类型有非极性键和离子键.
(8)在②、⑥两种元素形成的简单氢化物中,沸点较高的是水,其主要原因是水分子之间有氢键;
(9)将④、⑨两种元素的单质组成的混合物9.8g溶解在过量某浓度的稀硝酸中,完全反应,假设硝酸的还原产物全部为NO,其物质的量为0.2mol,则向反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量是20g.
分析 根据元素在周期表中的物质可知元素的种类①是Be,②是O,③是Na,④是Mg,⑤是Al,⑥是S,⑦是Cl,⑧是K,⑨是Fe,则
(1)⑨为Fe元素,根据题中图可知其位置;
(2)⑥是S,⑦是Cl,⑧是K,根据电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小;
(3)③是Na,④是Mg,⑤是Al,⑧是K,元素的金属性越强,其最高价氧化物的水化物的碱性越强;
(4)氢氧化铍与氢氧化钠性质相似,据此写氢氧化铍与氢氧化钠的反应方程式;
(5)④是Mg,⑦是Cl,形成化合物时,镁失去2个电子,每个氯原子得一个电子,据此写出它们形成化合物的过程;
(6)⑥为S,对应18电子的离子和H+及OH-均可发生反应,应为HS-;
⑧⑤⑨⑥⑨③为Na,⑤为Al,⑦为Cl元素,对应的化合物分别为NaCl和AlCl3;
(7)②是O,③是Na,②、③两种元素的单质在加热条件下发生反应生成的产物为过氧化钠;
(8)②是O,⑥是S,它们的氢化物中,水分子之间有氢键;
(9)④是Mg,⑨是Fe,根据它们与硝酸反应的方程式可计算出各自的物质的量,再利用元素守恒可计算出沉淀的质量.
解答 解:根据元素在周期表中的物质可知元素的种类①是Be,②是O,③是Na,④是Mg,⑤是Al,⑥是S,⑦是Cl,⑧是K,⑨是Fe,则
(1)⑨为Fe元素,根据题中图可知其位于第四周期第ⅤⅢ族,
故答案为:第四周期第ⅤⅢ族;
(2)⑥是S,⑦是Cl,⑧是K,根据电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,所以半径S2->Cl->K+,
故答案为:S2->Cl->K+;
(3)③是Na,④是Mg,⑤是Al,⑧是K,其中金属性最K>Na>>Mg>Al,元素的金属性越强,其最高价氧化物的水化物的碱性越强,所以碱性强弱顺序为KOH>NaOH>Mg(OH)2>Al(OH)3,
故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3;
(4)氢氧化铍与氢氧化钠性质相似,所以氢氧化铍与氢氧化钠的反应方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,
故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5)④是Mg,⑦是Cl,形成化合物时,镁失去2个电子,每个氯原子得一个电子,它们形成化合物的过程为 ,
,
故答案为: ;
;
(6)⑥为S,对应18电子的离子和H+及OH-均可发生反应,应为HS-,反应的离子方程式为HS-+H+=H2S↑;HS-+OH-=S2-+H2O,
故答案为:HS-+H+=H2S↑;HS-+OH-=S2-+H2O;
(7)②是O,③是Na,②、③两种元素的单质在加热条件下发生反应生成的产物为过氧化钠,化学式为Na2O2,其中含有非极性键和离子键,
故答案为:Na2O2;非极性键和离子键;
(8)②是O,⑥是S,它们的氢化物中,水分子之间有氢键,所以沸点较高的是水,
故答案为:水;水分子之间有氢键;
(9)④是Mg,⑨是Fe,设9.8g混合物中含有Mg为xmol,Fe为ymol,硝酸的还原产物全部为NO,其物质的量为0.2mol,则反应中硝酸得电子的物质的量为0.6mol,则$\left\{\begin{array}{l}{2x+3y=0.6}\\{24x+56y=9.8}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.105}\\{y=0.13}\end{array}\right.$,所以生成氢氧化物沉淀的质量为0.105×(24+34)g+0.13×(56+51)g=20g,
故答案为:20.
点评 本题考查元素周期律和元素周期表的综合应用,题目难度中等,涉及的知识点较多,综合性较强,答题时注意把握元素周期律的递变规律.

| A. | Na2S的水解:S2-+2H2O?H2S+2OH- | |
| B. | NaHCO3的电离:NaHCO3 ?Na++H++CO32- | |
| C. | HSO3-的电离:HSO3-?H++SO32- | |
| D. | 钢铁的电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
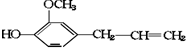 其可能具有的性质是:①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应( )
其可能具有的性质是:①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应( )| A. | 全部 | B. | 仅①②③④ | C. | 除⑥外都能 | D. | 除④⑥外都能 |
| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | KCl和K | D. | CO2和H2O |
| A. | 11.11 | B. | 22.22 | C. | 30.00 | D. | 32.00 |
| A. | CH3OH | B. | CH3CH2OH | C. |  | D. |  |

| A. | 该反应为放热反应 | |
| B. | 该反应可为Ba(OH)2•8H2O与NH4Cl晶体的反应 | |
| C. | 该反应可为甲烷在氧气中的燃烧反应 | |
| D. | 该反应只有在加热条件下才能进行 |