题目内容
4.某有机物完全燃烧生成CO2和H2O,CO2标准状况下的体积为4.48L,H2O的质量为5.4g,(1)若此有机物的质量为3g,则此有机物的结构简式是CH3CH3;
(2)若此有机物的质量为4.6g,则此有机物的结构简式是CH3CH2OH或CH3OCH3;
(3)等物质的量的此二种有机物完全燃烧,消耗氧气最多的是C2H6(写分子式)
分析 (1)计算二氧化碳、水的物质的量,进而计算碳元素、氢元素的物质的量、质量,结合质量守恒判断是否含有氧元素,计算元素原子个数之比,据此确定实验式,进而确定结构简式;
(2)根据质量守恒,确定有机物中是否含有氧,以此该求出有机物的化学式,进而确定其结构简式;
(4)1mol有机物CxHyOz的耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,据此解答判断.
解答 解:二氧化碳的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,水的物质的量=$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=2n(H2O)=0.6mol,m(H)=0.6g;
(1)m(C)+m(H)=3g,因有机物的质量为3g,所以有机物中没有氧元素,则有机物的实验式为CH3,所以分子式为C2H6,故答案为:CH3CH3;
(2)若有机物的质量为4.6g,则氧元素质量=4.6g-0.2mol×12g/mol-0.3mol×2×1g/mol=1.6g,则氧原子物质的量=$\frac{1.6g}{16g/mol}$=0.1mol,故有机物中C、H、O原子个数之比=0.2mol:0.6mol:0.1mol=2:6:1,有机物的实验式为C2H6O,H原子已经饱和,故实验式即为分子式,有机物结构简式为:CH3CH2OH或CH3OCH3,故答案为:CH3CH2OH或CH3OCH3;
(3)1molCH3CH3完全燃烧耗氧量为(2+$\frac{6}{4}$)mol=3.5mol,1molC2H6O完全燃烧耗氧量为(2+$\frac{6}{4}$-$\frac{1}{2}$)=3mol,等物质的量时,消耗氧气最多的是CH3CH3,
故答案为:C2H6.
点评 本题考查有机物分子式的确定,关键是利用质量守恒定律判断是否含有氧元素,难度不大,注意对基础知识的理解掌握.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | CH3OH | B. | CH3CH2OH | C. | 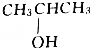 | D. | 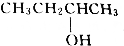 |
| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>O,△H3<0 | B. | △H2<0,△H4>0 | C. | △H2=△H1-△H3 | D. | △H3=△H4+△H1 |
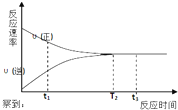 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )| A. | t1时刻,v(正)>v(逆) | B. | t2时刻,v(正)=v(逆) | ||
| C. | t2时刻,反应达到最大限度 | D. | t3时刻,反应停止 |
| A. | 三种微粒都能独立稳定存在 | B. | 三种微粒的形状相同 | ||
| C. | 三种微粒中碳原子的杂化方式相同 | D. | 键角大小关系:CH3+>CH3- |
| A. | 150 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-l CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
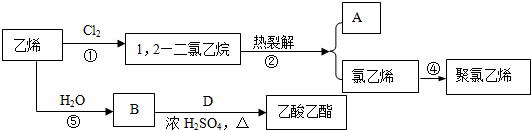
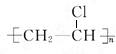 .
.