题目内容
5.欲配制一定温度下的某NaOH溶液,已知:该溶液体积为V mL,溶液密度为d g/cm3,质量分数(质量百分比浓度)为w%,物质的量浓度为c mol/L,溶液中含氢氧化钠的质量为m g.试回答下列问题.(1)计算:用w、d表示溶液中溶质的物质的量浓度c为0.25dwmol/L.
(2)某学生用托盘天平称量小烧杯的质量(烧杯中盛NaOH),称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将高于(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为往左盘添加药品,假定最终称量小烧杯的质量为32.6g(填“32.6g”或“32.61g”).
(3)在标尺(图)上画出游码位置(画“△”表示).

(4)定容后将溶液振荡均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线,则测得溶液的物质的量浓度将偏小(填“偏大”、“偏小”或“无影响”).
分析 (1)溶液物质的量浓度c=$\frac{1000ρω}{M}$;
(2)称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,说明左边托盘质量小于右边托盘质量,则右边托盘下降;欲使天平平衡,需要向左盘添加药品;托盘天平的感量是0.1g;
(3)游码的质量是2.6g;
(4)根据c=$\frac{n}{V}$判断配制溶液误差,如果n偏小或V偏大都导致c偏小,如果n偏大或V偏小都导致c偏大.
解答 解:(1)溶液物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×d×w%}{40}$mol/L=0.25dwmol/L,
故答案为:0.25dwmol/L;
(2)称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,说明左边托盘质量小于右边托盘质量,则右边托盘下降,所以左盘高于右盘;欲使天平平衡,需要向左盘添加药品;托盘天平的感量是0.1g,所以称量药品质量为32.6g,
故答案为:高于;往左盘添加药品;32.6g;
(3)游码的质量是2.6g,其图为 ,故答案为:
,故答案为: ;
;
(4)根据c=$\frac{n}{V}$判断配制溶液误差,如果n偏小或V偏大都导致c偏小,如果n偏大或V偏小都导致c偏大,
定容后将溶液振荡均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线,导致V偏大,则c偏小,故答案为:偏小.
点评 本题考查一定物质的量浓度溶液配制,侧重考查基本操作及误差分析,注意托盘天平的感量及误差分析,为易错点.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
12.乙酸与某饱和一元醇完全反应后,生成的有机物的相对分子质量为乙酸的相对分子质量的1.7倍,则该醇可能为( )
| A. | CH3OH | B. | CH3CH2OH | C. | 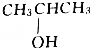 | D. | 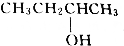 |
16.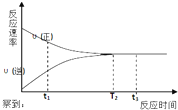 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示.下列判断不正确的是( )| A. | t1时刻,v(正)>v(逆) | B. | t2时刻,v(正)=v(逆) | ||
| C. | t2时刻,反应达到最大限度 | D. | t3时刻,反应停止 |
13.下列关于CH3+、-CH3、CH3-三种微粒的说法正确的是( )
| A. | 三种微粒都能独立稳定存在 | B. | 三种微粒的形状相同 | ||
| C. | 三种微粒中碳原子的杂化方式相同 | D. | 键角大小关系:CH3+>CH3- |
10.对下列有关实验的描述正确的是( )
| A. | 配制银氨溶液时,将硝酸银溶液逐滴滴入氨水中 | |
| B. | 乙醇中混有乙酸,加蒸馏水,然后分液 | |
| C. | 苯中混有苯酚,加浓溴水,然后分液 | |
| D. | 溴苯中混有溴,加NaOH溶液,然后分液 |
17.下列关于有机化合物的叙述中不正确的是( )
| A. | 丙烷跟甲烷一样能与氯气发生取代反应 | |
| B. | 1 mol乙酸与乙醇在一定条件下发生酯化反应,可生成1 mol乙酸乙酯 | |
| C. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
14.下列溶液中的Cl-浓度与50mL1mol•L一1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-l CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
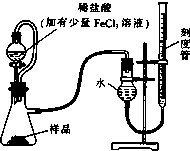 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.