题目内容
12.锂离子电池种类很多,其中有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中而形成的,电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述中错误的是( )| A. | 电解质溶液中混入水,会影响电池反应 | |
| B. | 反应中,SOCl2既是溶剂,又是氧化剂 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2) 被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫物质的量之比为4:1 |
分析 A、金属锂可以和水反应,则电解质应为非水溶液;
B、SOCl2中S元素的化合价由+4价降低为0;
C、亚硫酰氯被还原为S;
D、由8Li+3SOCl2═6LiCl+Li2SO3+2S~8e-计算.
解答 解:A、金属锂可以和水反应,在该电池中,电解质溶液中混入水,会影响电池反应,故A正确;
B、电池的总反应式8Li+3SOCl2═6LiCl+Li2SO3+2S,SOCl2中S元素的化合价由+4价降低为0,作氧化剂,所以SOCl2既是溶剂,又是氧化剂,故B正确;
C、电池的总反应式8Li+3SOCl2═6LiCl+Li2SO3+2S,即SOCl2中S由+4价还原为S为0价,不是被还原为Li2SO3,故C错误;
D、根据电池的总反应式:8Li+3SOCl2═6LiCl+Li2SO3+2S,负极消耗的锂与正极生成的硫物质的量之比为8:2=4:1,故D正确;
故选C.
点评 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
2.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数均为K=2 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
3.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Na2O和Na2O2的混合物中,阴阳离子总数为3NA | |
| B. | 非标准状况下,NA个CO2分子所占的条件不可能为22.4L | |
| C. | 24.4gNa2O•SiO2中含有0.2NA个SiO2分子 | |
| D. | 56gFe投入1000mL3.5mol•L-1稀硝酸中,充分反应,转移电子总数为3NA |
20.铝是我们很熟悉的一种金属元素,铊(Tl)和铝均位于元素周期表中的第ⅢA族,铊属于第三周期.则关于铊的下列性质中判断错误的是( )
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
7.氮和硅均是自然界含量非常丰富的元素.
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:
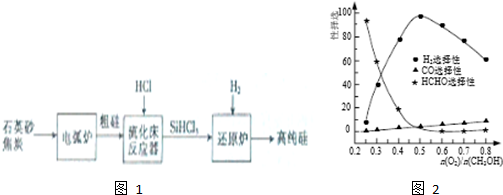
①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
(4)“硅能源”有望成为二十一世纪的新能源.1mol硅完全燃烧能放出910kJ的热量,写出该反应的热化学方程式:Si(S)+O2(g)═SiO2(S)△H=-910KJ/mol;与“氢能源”比较“硅能源”具有的优点是产物不污染环境,储存、运输方便.
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
(1)氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
(2)向大气中排放NOx可能导致的环境问题有酸雨、光化学烟雾、臭氧层破坏(任一点均可).(任答一点)用足量NaOH溶液能完全吸收NO2生成NaNO2、NaNO3和H2O2.试写出该反应的离子方程式:2NO2+2OH-═NO3-+NO2-+H2.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种技术路线,其中一种工艺流程如图1:

①电弧炉中发生的主要反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(5)工业上常利用甲醇部分氧化法制备氢气.在一定温度下以Ag/CeO2-SiO2为催化剂时原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示.则当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$=0.25时,CH3OH与O2发生的主要反应方程式为2CH3OH+O2$→_{△}^{催化剂}$2HCHO+2H2O;当$\frac{n({O}_{2})}{n(C{H}_{3}OH)}$>0.5时,H2选择性下降的原因氧气过量,与氢气反应生成水.
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
4.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同.X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物.根据以上叙述,下列说法不正确的是( )
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
1.分析下列各项结构的规律,按此规律排布第10项的分子式应为( )
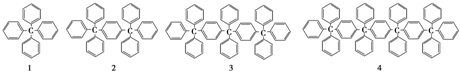

| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
2.黑火药在适当的外界能量作用下,能进行迅速而有规律的燃烧,瞬间产生大量的热和氮气、二氧化碳等气体,由于体积急剧膨胀,压力猛烈增大,于是发生了爆炸.反应方程式为S+2KNO3+3C═K2S+N2↑+3CO2↑,下列说法不正确的是( )
| A. | S和KNO3都是反应的氧化剂 | B. | C在反应中得电子 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |