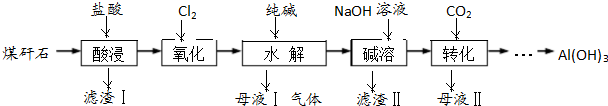
题目内容
2.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数均为K=2 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
分析 乙、丙转化到左边,SO2、O2的物质的量分别为2mol、1mol,与甲中SO2、O2的物质的量对应相等,恒温恒容条件下,丙中Ar不影响平衡移动,故三者为完全等效平衡,平衡时SO2、O2、SO3的物质的量对应相等.
A.根据参加反应二氧化硫的物质的量判断方程热量多少;
B.平衡常数只受温度影响,对于同一反应,温度相同,平衡常数相同,根据乙中反应热计算参加反应二氧化硫的物质的量,进而计算其浓度变化量,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
C.根据B中计算可知甲中平衡时二氧化硫的物质的量,进而计算甲中二氧化硫的转化率,正反应为放热反应,升高温度平衡向逆反应方向移动;
D.由B中计算可知氧气浓度变化量,再结合v=$\frac{△c}{△t}$计算v(O2).
解答 解:乙、丙转化到左边,SO2、O2的物质的量分别为2mol、1mol,与甲中SO2、O2的物质的量对应相等,恒温恒容条件下,丙中Ar不影响平衡移动,故三者为完全等效平衡,平衡时SO2、O2、SO3的物质的量对应相等.
A.由于平衡时二氧化硫物质的量相等,故参加反应二氧化硫的物质的量:甲>乙=丙,故放出热量:Q1>Q3=Q2=78.8kJ,故A错误;
B.甲、乙、丙三容器温度相同,平衡常数相同,乙中平衡时放出热量为78.8kJ,由2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1可知,参加反应的二氧化硫为2mol×$\frac{78.8kJ}{197kJ}$=0.8mol,则二氧化硫浓度变化量为$\frac{0.8mol}{2L}$=0.4mol/L,SO2、O2、SO3的起始浓度分别为$\frac{1.8mol}{2L}$=0.9mol/L、$\frac{0.9mol}{2L}$=0.45mol/L、$\frac{0.2mol}{2L}$=0.1mol/L,则:
2SO2(g)+O2(g)?2SO3(g)
起始(mol/L):0.9 0.45 0.1
转化(mol/L):0.4 0.2 0.4
平衡(mol/L):0.5 0.25 0.5
故平衡常数K=$\frac{0.{5}^{2}}{0.{5}^{2}×0.25}$=4,故B错误;
C.乙中平衡时二氧化硫物质的量为1.8mol-0.8mol=1mol,甲中参加反应二氧化硫为2mol-1mol=1mol,甲中二氧化硫的转化率$\frac{1mol}{2mol}$×100%=50%,正反应为放热反应,升高温度平衡向逆反应方向移动,SO2的转化率将小于50%,故C错误;
D.乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{0.2mol/L}{tmin}$=$\frac{1}{5t}$ mol/(L•min),故D正确,
故选D.
点评 本题考查等效平衡、化学平衡计算、化学平衡常数计算、化学反应速率计算、化学平衡影响因素等,关键是理解等效平衡规律,注意丙中稀有气体在恒温恒容条件下不影响平衡移动,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 硫是氧化剂,KOH是还原剂 | |
| B. | 反应中共转移4摩尔电子 | |
| C. | 还原剂和氧化剂质量比是1:2 | |
| D. | 氧化产物和还原产物的质量比是1:2 |
| A. | 钠和钾的合金具有导电性,可用于中子反应堆热交换剂 | |
| B. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 |
| A. | 按系统命名法,化合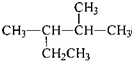 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: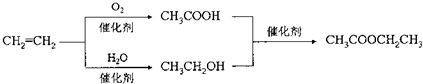 |
| A. | 酯的一般通式是RCOOR′和R′可以相同,也可以不同 | |
| B. | RCOOR′和R′可以是脂肪烃基,也可以是芳香烃基 | |
| C. | 在RCOOR′中,当R和R′均为-CH3时,这种酯叫甲酸甲酯 | |
| D. | 碳原子数相同的饱和一元羧酸和饱和一元酯互为同分异构体 |
| A. | 目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 | |
| B. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代,利用此类光显微镜可以观察活细胞内蛋白质等大分子 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
| A. | 电解质溶液中混入水,会影响电池反应 | |
| B. | 反应中,SOCl2既是溶剂,又是氧化剂 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2) 被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫物质的量之比为4:1 |
 .
.