题目内容
15.现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg•mol-1.则:(1)该气体的物质的量为$\frac{m}{M}$mol.
(2)该气体所含原子总数为$\frac{2{mN}_{A}}{M}$个.
(3)该气体在标准状况下的体积为22.4$\frac{m}{M}$L.
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为$\frac{100m}{m+1000}$%.
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为$\frac{m}{VM}$mol/L.
分析 根据公式n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=cBV计算n、N、V、c;结合质量分数的定义计算该气体溶于水形成溶液的质量分数.
解答 解:m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol-1
(1)该气体的物质的量为n=$\frac{mg}{Mg{•mol}^{-1}}$=$\frac{m}{M}$mol,
故答案为:$\frac{m}{M}$;
(2)该气体所含原子总数为N=2×$\frac{m}{M}$mol×NAmol-1=$\frac{2{mN}_{A}}{M}$;
故答案为:$\frac{2{mN}_{A}}{M}$;
(3)在标准状况下该气体的体积为V=$\frac{m}{M}$mol×22.4L/mol=22.4$\frac{m}{M}$L,
故答案为:22.4$\frac{m}{M}$;
(4)水的质量为1000ml×1g/ml=1000g,所以mg该气体溶于水质量分数为$\frac{mg}{mg+1000g}$×100%=$\frac{100m}{m+1000}$%,
故答案为:$\frac{100m}{m+1000}$%;
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为c=$\frac{\frac{m}{M}mol}{VL}$=$\frac{m}{VM}$mol/L,
故答案为:$\frac{m}{VM}$.
点评 本题考查物质的量、溶液浓度有关计算,熟悉基本计算公式即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.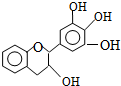 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液发生显色反应且能发生水解反应 |
3.下列说法正确的是( )
| A. | 冰中每个水分子平均形成两个氢键 | |
| B. | 冰、“可燃冰”、干冰都具有分子密堆积特征 | |
| C. | 分子晶体中一定不存在单个的原子 | |
| D. | “可燃冰”不属于分子晶体 |
10.下列电离方程式的书写错误的是( )
| A. | NaHSO4═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | HCl═H++Cl- | D. | BaSO4═Ba2++SO42- |
7.下列离子方程式书写正确的是( )
| A. | 金属钠投入到水中 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液与盐酸反应:HCO3-+H+═CO2↑+H2 O | |
| C. | 强酸与强碱反应:H++OH-═H2O | |
| D. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O |
8.下列说法正确的是( )
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
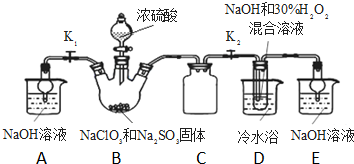 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: