题目内容
8.下列说法正确的是( )| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
分析 A.非金属元素的单质的氧化性越强,则非金属性越强,但是不能根据还原性比较非金属性;
B.等浓度的Na2CO3溶液比Na2SO4溶液的pH大,则碳酸的酸性小于硫酸,以此比较非金属性;
C.能够使澄清石灰水变浑浊的气体有二氧化硫和二氧化碳,所以溶液中可能含有亚硫酸根离子、碳酸氢根离子等;
D.某过程发生化学键断裂,不一定发生化学变化.
解答 解:A.非金属元素的单质的氧化性越强,则非金属性越强,在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,C作还原剂,不能根据高温下非自发反应比较非金属性,所以不能推知碳的非金属性强于硅的非金属性,故A错误;
B.等浓度的Na2CO3溶液比Na2SO4溶液的pH大,则碳酸的酸性小于硫酸,最高价氧化物的水化物的酸性越强,非金属性越强,故B正确;
C.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体可能为二氧化碳、二氧化硫,溶液中可能存在亚硫酸根离子、亚硫酸氢根离子、碳酸氢根离子,所以该溶液中不一定存在大量CO32-,故C错误;
D.某过程发生化学键断裂,不一定发生化学变化,如HCl溶于水,没有化学键生成,故D错误;
故选:B.
点评 本题考查了元素非金属性强弱判断的依据、实验方案的评价,注意离子检验中应排除干扰,题目难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
19.下列说法正确的是( )??
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构简式为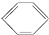 有三个双键,可与溴水发生加成反应 有三个双键,可与溴水发生加成反应 | |
| C. | 苯的6个碳原子和6个氢原子在同一平面内 | |
| D. | 将1 mL苯和1 mL水充分混合后静置,二者互溶 |
16.根据下列几种物质熔点和沸点的数据,判断下列说法中错误的是( )
注:AlCl3熔点在2.5×105Pa条件下测定.
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1418 | 182.7 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | KCl的熔点大于810℃ |
13.下列各组内的物质不属于同系物的是( )
| A. | CH3-CH3 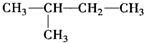 | |
| B. | CH2═CH-CH3 CH2═CH-CH2-CH3 | |
| C. | CH3-CH2-OH CH3-CH2-CH2-CH3 | |
| D. | 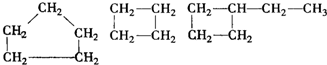 |
20.X、Y均为短周期元素,两者组成化合物的化学式为X2Y3,已知X的原子序数为m,则Y的原子序数不可能是( )
| A. | m+11 | B. | m+4 | C. | m-6 | D. | m-5 |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 加NaOH后加热有气体放出且有沉淀生成的溶液:Ca2+、HCO3-、NH4+、CH3COO- | |
| C. | 与铝反应产生大量氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| D. | 遇苯酚显紫色的溶液:I-、K+、SO42-、Mg2+ |


 ;
;