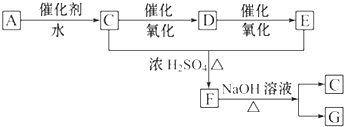
题目内容
20.有下列九种晶体,完成下列各小题.A.干冰 B.氧化钠 C.冰醋酸 D.金刚砂 E.氯化铵
F.晶体氖 G.锌 H.C60 I.金刚石
(1)属于分子晶体的是ACFH,属于原子晶体的是DI,属于离子晶体的是BE.
(2)属于电解质的是BCE.
(3)直接由原子构成的晶体是DFI.
(4)含有极性共价键的晶体是ACDE.
(5)晶体中有氢键的是C,受热熔化需克服共价键的是DI.
分析 (1)根据晶体的构成微粒确定晶体类型,分子晶体的构成微粒是分子、原子晶体的构成微粒是原子、离子晶体的构成微粒是阴阳离子;
(2)在水溶液中或熔融状态下能导电的化合物是电解质;
(3)原子晶体和单原子分子晶体是直接由原子构成的;
(4)不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;
(5)冰醋酸中含有氢键;原子晶体熔融需要克服共价键.
解答 解:(1)根据晶体的构成微粒确定晶体类型,分子晶体的构成微粒是分子、原子晶体的构成微粒是原子、离子晶体的构成微粒是阴阳离子,ACFH是分子晶体、DI是原子晶体、BE是离子晶体,故答案为:ACFH;DI;BE;
(2)在水溶液中或熔融状态下能导电的化合物是电解质,属于电解质的是BCE,故答案为:BCE;
(3)原子晶体和单原子分子晶体是直接由原子构成的,直接由原子构成的晶体是DFI,故答案为:DFI;
(4)不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有极性键的物质由ACDE,故答案为:ACDE;
(5)冰醋酸中含有氢键;原子晶体熔融需要克服共价键,所以熔融需要克服共价键的是DI,故答案为:C;DI.
点评 本题考查晶体类型判断、电解质判断、化学键等知识点,侧重考查基本概念,明确概念内涵是解本题关键,注意稀有气体是单原子分子,原子晶体熔融需要克服共价键、分子晶体熔融需要克服分子间作用力,知道二者的区别.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
10.根据能量变化示意图,确定下列选项中正确的是( )
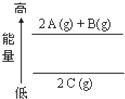

| A. | 2A(g)+B(g)=2 C(g)△H<0 | B. | 2A(g)+B(g)=2 C(g)△H>0 | C. | 2C(g)=2A(g)+B(g)△H>0 | D. | 2C(g)=2 A(g)+B(g)△H<0 |
11.工业制ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是( )
| A. | NaClO3在反应中化合价降低,失去电子 | |
| B. | SO2在反应中发生氧化反应 | |
| C. | 2mol氧化剂在反应中得到2mol电子 | |
| D. | H2SO4在反应中作氧化剂 |
8.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| C. | 在常温常压下,1摩尔气体含有的原子数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
5.在同温同压下,两个容积相同的储气瓶,一个装满O2,另一个装满CH4,以下有关两瓶气体的计算不正确的是( )
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |
12.下列物质分类正确的是( )
| A. | FeO、Fe2O3、Na2O2均为碱性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 盐酸、水玻璃、氨水均为混合物 |
13.下列各组内的物质不属于同系物的是( )
| A. | CH3-CH3 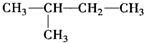 | |
| B. | CH2═CH-CH3 CH2═CH-CH2-CH3 | |
| C. | CH3-CH2-OH CH3-CH2-CH2-CH3 | |
| D. | 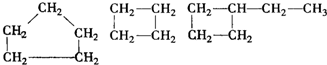 |