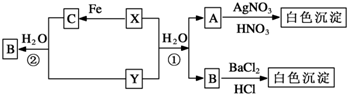
题目内容
18.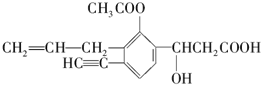 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题:(1)写出其分子式C16H16O5.
(2)其中含有12个不饱和碳原子,分子中有2种双键.
(3)分子中的极性键有C=O、C-O、C-H、O-H(写出两种即可).
(4)分子中的饱和碳原子有4个;一定与苯环处于同一平面的碳原子有4个.
(5)分子中C-C═O键角为120°,C≡C-H键角为180°.
分析 根据有机物结构简式可确定有机物分子式,有机物含有碳碳双键、碳碳三键、酯基、羟基以及羧基,结合苯环的平面形结构特点解答该题.
解答 解:(1)有结构简式可知分子式为C16H16O5,故答案为:C16H16O5;
(2)与双键相连的碳原子为不饱和碳原子,有12个不饱和碳原子;分子中含有C=C、C=O两种双键,故答案为:12;2;
(3)由不同原子形成的共价键为极性键,含有C=O、C-O、C-H、O-H等,故答案为:C=O、C-O、C-H、O-H;
(4)饱和碳原子核外四个电子全部与其他原子形成共用电子对,并且只形成单键,分子中的饱和碳原子有4个;与苯环直接相连的原子与苯环共平面,C≡C为直线形,则分子中一定与苯环处于同一平面的碳原子数有4个,故答案为:4;4;
(5)C-C═O中碳原子为sp2杂化,键角为120°,C≡C-H中碳原子为sp杂化,键角为180°,故答案为:120°;180°.
点评 本题考查有机物结构和性质,为高频考点,侧重于学生的分析能力的考查,明确官能团及性质的关系即可解答,题目难度不大.

练习册系列答案
相关题目
9.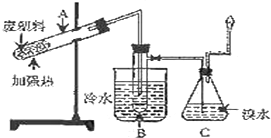 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
(1)废塑料充分加热后,试管A中的残余物有多种用途,如可通过下列转化制取高聚物聚乙炔:
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为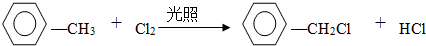 .
.
(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为
 .
.(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
3.下列离子方程式书写正确的是( )
| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
10.某原电池装置如图所示.下列有关叙述中,正确的是( )
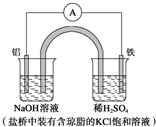

| A. | Fe作正极,发生氧化反应 | |
| B. | 负极反应:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段时间后,盛有稀硫酸溶液的杯中pH不变 | |
| D. | 盐桥中的Cl-向左边烧杯中移动,使该烧杯中溶液保持电中性 |
 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +2nH2O.
+2nH2O.