题目内容
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
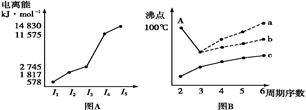
(Ⅰ)原子半径:A < C < B < E < D
(Ⅱ)原子的最外层电子数:A = D, C = E, A+B = C。
(Ⅲ)原子的核外电子层数:B = C = 2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价 = 2
(Ⅴ)F的单质或合金是用量最大的金属材料。
请回答:(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ;
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: 。
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为: 。
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中c(SO42-)为: (已知:忽略溶液体积变化。该沉淀的Ksp=2×10-9)
(1)
(2)3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(3)SO2+2H2S=3S+2H2O
(4)NH4Fe(SO4)2,向该盐溶液中加入硫氰化钾溶液,溶液变红则含有Fe3+
(5)5×10-9mol/l
解析试题分析:根据题意可推知:A是H;B是N;C是O;D是Na;E是S;F是Fe。(1)甲是NH3,其电子式为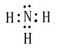 。(2)Fe3O4和稀硝酸反应的化学方程式为3Fe3O4+28HNO3=3Fe(NO3)3+NO↑+14H2O;将其改写为离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O。(3)(3)由H、O、S三种元素组成的两种气体相互反应能生成淡黄色固体的化学反应方程式为SO2+2H2S=3S+2H2O。(4)复盐是由两种不同的金属阳离子与一种酸根离子组成的化合物。向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,证明含有SO42-;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,证明含有NH4+;另一种阳离子为Fe2+或Fe3+。因为该复盐由三种离子组成且离子个数比为1:1:2,根据在化合物中正负化合价的代数和为0,的原则,因此含有的另一种金属阳离子为Fe3+。该盐的化学式为NH4Fe(SO4)2。检验Fe3+的方法是取盐溶液少许,向该盐溶液中加入硫氰化钾溶液,若溶液变红则含有Fe3+。(5)n(Ba2+)=0.06mol,n(SO42-)=0.1×0.1×2mol=0.02mol.因为发生反应:Ba2++ SO42-=BaSO4↓。二者的物质的量的比为1:1,所以Ba2+过量,反应后溶液中的c(Ba2+)=(0.06-0.02)mol÷0.1L=0.4mol/L.由于BaSO4Ksp=2×10-9,所以
。(2)Fe3O4和稀硝酸反应的化学方程式为3Fe3O4+28HNO3=3Fe(NO3)3+NO↑+14H2O;将其改写为离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O。(3)(3)由H、O、S三种元素组成的两种气体相互反应能生成淡黄色固体的化学反应方程式为SO2+2H2S=3S+2H2O。(4)复盐是由两种不同的金属阳离子与一种酸根离子组成的化合物。向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,证明含有SO42-;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,证明含有NH4+;另一种阳离子为Fe2+或Fe3+。因为该复盐由三种离子组成且离子个数比为1:1:2,根据在化合物中正负化合价的代数和为0,的原则,因此含有的另一种金属阳离子为Fe3+。该盐的化学式为NH4Fe(SO4)2。检验Fe3+的方法是取盐溶液少许,向该盐溶液中加入硫氰化钾溶液,若溶液变红则含有Fe3+。(5)n(Ba2+)=0.06mol,n(SO42-)=0.1×0.1×2mol=0.02mol.因为发生反应:Ba2++ SO42-=BaSO4↓。二者的物质的量的比为1:1,所以Ba2+过量,反应后溶液中的c(Ba2+)=(0.06-0.02)mol÷0.1L=0.4mol/L.由于BaSO4Ksp=2×10-9,所以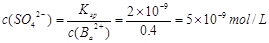 。
。
考点:考查元素的推断、物质的鉴定、离子的检验、离子方程式的书写及沉淀溶解平衡的应用的知识。

 初中暑期衔接系列答案
初中暑期衔接系列答案下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | ⑨ | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | | |
(1)化学性质最不活泼的元素是 (填元素符号),其原子结构示意图为 。
(2)元素⑧的名称为 ,其最高价氧化物的水化物的化学式为 。
(3)元素③与元素⑧形成化合物的电子式为 。
(4)非金属性最强的元素是 (填元素符号)。除0族外原子半径最大的元素是 (填元素符号)。元素①单质与水反应的离子方程式是 。
(5)①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是 。
(6)能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式 。
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| A | A的基态原子最外层电子排布式为2s22p3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
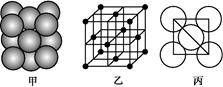
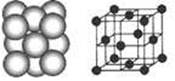
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
(1)在标号元素中,最活泼的金属元素是 。最活泼的非金属元素是 。⑨元素的离子结构示意图是 。
(2)①与②形成共价化合物的电子式 。用电子式表示⑤与⑨形成化合物的形成过程 。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 。
⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 。
(5)写出⑥元素的单质与盐酸反应的离子方程式: 。