题目内容
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
(1)Na>S>O(1分) (2)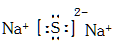 (1分) (3) H2O H2S(各1分)
(1分) (3) H2O H2S(各1分)
(4) H2O2+SO2=H2SO4(2分)
(5)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(2分,不写稀扣1分)
(6)NH4++HSO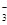 +2OH- △NH3↑+SO32—+ 2H2O(2分,不写加热扣1分)
+2OH- △NH3↑+SO32—+ 2H2O(2分,不写加热扣1分)
(5) c(HC2O )>c(H+)>c(C2O
)>c(H+)>c(C2O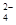 )(2分)反应生成的MnSO4能催化该反应,加快反应速率。(2分)
)(2分)反应生成的MnSO4能催化该反应,加快反应速率。(2分)
解析试题分析:X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,W是地壳中含量最多的元素,因此W是O。W与Q同主族,因此Q是S。X是原子半径最小的元素,则X是H。X与M同主族,且M的原子序数大于氧元素,则M是Na。常温下,六种元素的常见单质中三种为气体,三种为固体,且X能与Y、Z、W分别形成电子数相等的三种分子,所以Y是C,Z是N。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则W、M、Q四种元素的原子半径由大到小的排列顺序是Na>S>O。
(2)元素M和Q可以形成化合物Na2S,含有离子键的离子化合物,电子式为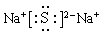 。
。
(3)非金属性越强,氢化物的稳定性越强,Z、W、Q三种元素的非金属性强弱顺序为O>N>S,则简单气态氢化物中稳定性最强的是H2O。由于水分子间以及氨气分子间均存在氢键,所以沸点最低的是H2S。
(4) W的一种氢化物含18个电子, 则该氢化物是双氧水。双氧水与SO2化合的化学方程式为H2O2+SO2=H2SO4。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,因此是稀硝酸,则该反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,则A应该是亚硫酸氢铵,因此A与足量氢氧化钠溶液在加热条件下反应的离子方程式为NH4++HSO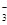 +2OH- △NH3↑+SO32—+ 2H2O。
+2OH- △NH3↑+SO32—+ 2H2O。
(7)分子式为X2Y2W4的化合物是乙二酸,与含等物质的量的KOH的溶液反应后得到草酸氢钾,所得溶液呈酸性,说明草酸氢根的电离程度大于其水解程度,所以该溶液中各离子浓度由大到小的顺序为c(K+)>c(HC2O )>c(H+)>c(C2O
)>c(H+)>c(C2O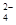 )>c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。因此根据外界条件对反应速率的影响分析,此时影响因素应该考虑催化剂,即由于反应生成的MnSO4能催化该反应,从而加快反应速率。
)>c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。因此根据外界条件对反应速率的影响分析,此时影响因素应该考虑催化剂,即由于反应生成的MnSO4能催化该反应,从而加快反应速率。
考点:考查元素推断、元素周期律的应用;氧化还原反应、溶液中离子浓度大小比较以及外界条件对反应速率的影响等

(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
下表为元素周期表的一部分,其中的字母代表相应的元素。
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | b | c | d | | |
| | e | | | | | | | | | | | f | | g | | | |
| | | | | | | | | h | I | | | | | | | | |
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为 。(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为 。
1 mol 苯甲醛分子中含有σ键的数目为 。
(4)元素d与e形成的化合物常用于制作 材料,其原因是 。
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为 。
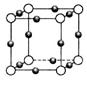
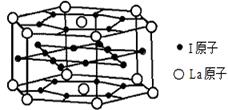
(6)元素I的合金可用来储存a的单质,该合金的晶胞结构如图所示,则此合金的化学式为 。
(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
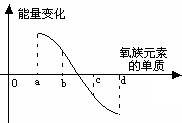
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| | C-O | C=O | C≡O |
| CO | 357.7 | 798.9 | 1071.9 |
| | N-N | N=N | N≡N |
| N2 | 154.8 | 418.4 | 941.7 |
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN-形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是 。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3-互为等电子体的分子 (写出一种)。
(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为
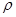 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含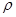 、NA的计算式表示)
、NA的计算式表示)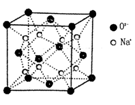
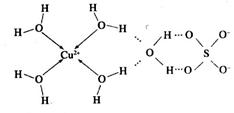
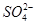 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。 配离子。已知
配离子。已知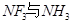 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。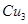 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。