题目内容
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
(1)在标号元素中,最活泼的金属元素是 。最活泼的非金属元素是 。⑨元素的离子结构示意图是 。
(2)①与②形成共价化合物的电子式 。用电子式表示⑤与⑨形成化合物的形成过程 。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 。
⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 。
(5)写出⑥元素的单质与盐酸反应的离子方程式: 。
(1)Na F 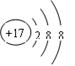
(2)
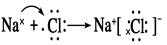
(3)Na>Al>Si
(4)HCl HClO4> H3PO4> H2SiO3
(5)2Al + 6H+ = 2Al3+ + 3H2↑
解析试题分析:同一周期的元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;不同周期的元素,元素的原子核外电子层数越多,原子半径越大,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱,因此金属性逐渐增强。(1)所以在标号元素中,最活泼的金属元素是⑤的Na。最活泼的非金属元素是④的F。⑨元素Cl的离子结构示意图是 .(2)①元素H与②元素C形成共价化合物CH4的电子式
.(2)①元素H与②元素C形成共价化合物CH4的电子式 。⑤Na与⑨Cl形成的离子化合物NaCl的形成过程电子式表示为:
。⑤Na与⑨Cl形成的离子化合物NaCl的形成过程电子式表示为: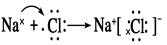 。(3)Na、Al、Si是同一周期的元素。随着原子序数的增大,原子的半径逐渐减小。因此这几种元素的原子半径大小关系为:Na>Al>Si。(4)Si、P、Cl是同种周期的元素。随着原子序数的增大,元素的非金属性逐渐增强,其形成的简单的氢化物的稳定性逐渐增强。元素的非金属性Cl>P>Si,所以气态氢化物中最稳定的是HCl。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以这三种元素的最高价含氧酸的酸性由强到弱的顺序是HClO4> H3PO4> H2SiO3 。(5)⑥Al元素的单质与盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+ 3H2↑,其离子方程式为:2Al + 6H+ = 2Al3+ + 3H2↑。
。(3)Na、Al、Si是同一周期的元素。随着原子序数的增大,原子的半径逐渐减小。因此这几种元素的原子半径大小关系为:Na>Al>Si。(4)Si、P、Cl是同种周期的元素。随着原子序数的增大,元素的非金属性逐渐增强,其形成的简单的氢化物的稳定性逐渐增强。元素的非金属性Cl>P>Si,所以气态氢化物中最稳定的是HCl。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以这三种元素的最高价含氧酸的酸性由强到弱的顺序是HClO4> H3PO4> H2SiO3 。(5)⑥Al元素的单质与盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+ 3H2↑,其离子方程式为:2Al + 6H+ = 2Al3+ + 3H2↑。
考点:考查元素的推断、原子结构示意图、电子式表示化合物及形成过程、元素的非金属性强弱的比较及离子方程式书写的知识。

I.用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)
(1)最高价氧化物的水化物碱性最强的是 ;其电子式为:
(2)最高价氧化物的水化物呈两性的是 ;
(3)能形成气态氢化物且最稳定的是 ,其电子式为 .
II.化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
下列说法错误的是 。
| A.将Cl2通入紫色石蕊试液,溶液先变红后褪色 |
| B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体 |
| D.常温下,可以用铁质容器储运浓硝酸 |
F.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
原子序数小于36的四种元素X、Y、Z、W,有关它们的信息如下表所示:
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子排布在三个能级上,且有三个电子能量相同 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的最外层电子数等于次外层电子数的2倍 | Y是形成化合物种类最多的元素 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W的一种核素质量数为52,中子数为28 | +6价W的化合物有强氧化性,可用于皮革加工、吹气法检查司机是否酒驾等 |
请填写下列空白(答题时X、Y、Z、W用相应的元素符号):
(1)X单质分子的电子式是________,σ键和π键的个数比是________。
(2)Z元素原子最外层共有________种不同运动状态的电子。Z的氢化物液态时________(填“能”或“不能”)导电。
(3)W的基态原子核外电子排布式是_____________________________。