题目内容
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| A | A的基态原子最外层电子排布式为2s22p3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
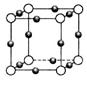
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
(1)3d104s1 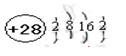
(2)N大于O
(3)sp2 CO2
(4)12
(5)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H="-Q" kJ/mol
(5) 3Na2O2+6FeCl2+6H2O=6NaCl+4Fe(OH)3↓+2FeCl3
3Na2O2+6FeCl2+6H2O=6NaCl+4Fe(OH)3↓+2FeCl3
解析

练习册系列答案
相关题目
(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式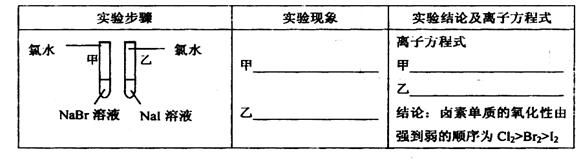
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
| 实验步骤 | 实验现象 | 实验依据和结论 |
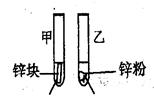 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074 nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
(1)写出C元素在周期表中的位置 ,写出D元素最高价氧化物的水化物电子式 ;
(2)写出B单质与水反应的离子方程式 ;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式 ;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为 ;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为 NA。
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有 种,属于d区的元素有 种。
(3)铜晶胞是面心立方结构。其空间利用率为 (用含“π”和“
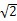 ”的式子表示,不必算结果)
”的式子表示,不必算结果) 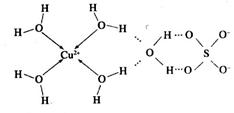
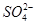 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。 配离子。已知
配离子。已知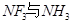 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。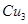 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。