题目内容
【题目】常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为___________
(已知:lg2 = 0.3)
【答案】pH=3-2lg2= 2.4
【解析】
c(Fe 2+)达到1mol/L,则根据FeS的Ksp=6.25×10-18可知硫离子的浓度为c(S2-)=6.25×10-18mol/L。又因为c2(H+)·c(S2-)=1.0×10-22,所以c(H+)=![]() ,所以pH=3-2lg2= 2.4。
,所以pH=3-2lg2= 2.4。

 53随堂测系列答案
53随堂测系列答案【题目】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________。
(3)相关物质的化学键键能数据如下:
化学键 | O=O(O2) | H—H | H—O |
E/(kJ·mol-1) | x | 436 | 463 |
计算x=________kJ·mol-1。
(4)某反应2X(g)+Y(g)2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
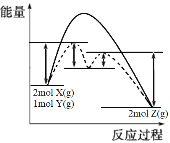
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。