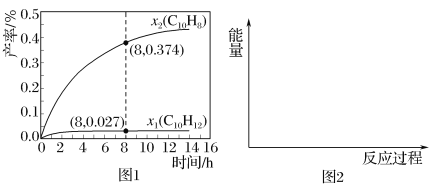
题目内容
【题目】下列说法正确的是
A.测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B.HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D.S燃烧热的热化学方程式为S(s)+![]() O2(g)=SO3(g) ΔH=315 kJ·mol-1
O2(g)=SO3(g) ΔH=315 kJ·mol-1
【答案】A
【解析】
A. 中和热测定需要测定开始时酸、碱溶液温度,反应终止时的最高温度,再根据Q=mc△T和△H=-![]() 计算中和热,故A正确;
计算中和热,故A正确;
B. 中和热是强酸和强碱的稀溶液反应生成1mol液态水放出的热量,同时SO42-和Ca2+生成CaSO4放热,所以稀H2SO4和稀Ca(OH)2溶液反应的中和热△H<-57.3kJmol-1,故B错误;
C. 燃烧热是在25℃和101kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,故C错误;
D. 燃烧热是1molS(s)燃烧生成稳定氧化物为SO2(g)时放出的热量,不是生成SO3(g)时放出的热量,故D错误;
故选:A。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___,B、C、N、O第一电离能由大到小的顺序为___,CH4、H2O、CO2的键角按照由大到小的顺序排列为___。
(2)与(HB=NH)3互为等电子体的有机分子为___(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
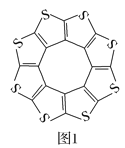
①C16S8分子中C原子和S原子的杂化轨道类型分别为___。
②相关键长数据如表所示:
化学键 | C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___。
③C16S8与H2微粒间的作用力是___。
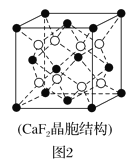
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___。
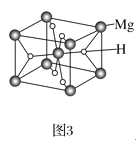
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(2)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
A.Ba(OH)2溶液 | B.BaCl2溶液 |
C.NaOH溶液 | D.澄清的石灰水 |
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。