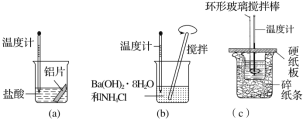
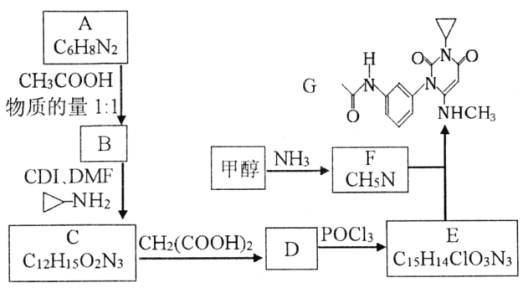
题目内容
【题目】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________。
(3)相关物质的化学键键能数据如下:
化学键 | O=O(O2) | H—H | H—O |
E/(kJ·mol-1) | x | 436 | 463 |
计算x=________kJ·mol-1。
(4)某反应2X(g)+Y(g)2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
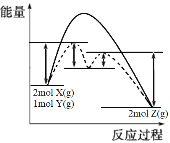
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。
【答案】-285.8kJ·mol-1 CO(g) + H2O (g) = H2(g) + CO2 (g) △H=-41.2kJ·mol-1 496.4 不变 第一步
【解析】
(1)在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热;
(2)根据盖斯定律继续计算;
(3)焓变=反应物键能-生成物键能,再根据氢气的燃烧热方程式计算;
(4)①反应热与反应路径无关;
②反应活化能大的一步决定反应速率。
(1)由反应② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
结合盖斯定律可知1mol氢气燃烧生成液体水放出的热量为241.8kJ+44.0kJ=285.8kJ,故答案为:-285.8kJ·mol-1;
(2)由反应① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
结合盖斯定律可知反应CO(g)+H2O(g)═CO2(g)+H2(g)可由①-②得到,所以该反应的△H=-283kJ·mol-1-(-241.8kJ·mol-1)=-41.2kJ·mol-1,故答案为:CO(g) + H2O (g) = H2(g) + CO2 (g) △H=-41.2kJ·mol-1;
(3)由第(1)题可知:H2(g)+![]() O2(g) = H2O (l) △H=-285.8kJ·mol-1,根据焓变=反应物键能-生成物键能可得436 kJ·mol-1+
O2(g) = H2O (l) △H=-285.8kJ·mol-1,根据焓变=反应物键能-生成物键能可得436 kJ·mol-1+![]() x-2×463 kJ·mol-1=-285.8kJ·mol-1,解得x=496.4kJ·mol-1,故答案为:496.4;
x-2×463 kJ·mol-1=-285.8kJ·mol-1,解得x=496.4kJ·mol-1,故答案为:496.4;
(4)①催化剂只改变反应活化能不改变焓变,故答案为:不变;
②根据图示可知第一步反应活化能较大,所以第一步决定反应速率,故答案为:第一步。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案