题目内容
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
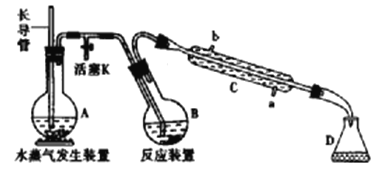
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
【答案】圆底烧瓶 不能 b 打开活塞K 保温,避免水蒸气冷凝 ab HF+OH-=F-+H2O 2.85%
【解析】
A水蒸气发生装置,长导管作用起到平衡压强的作用,防止烧瓶内压强过大,实验时,首先打开活塞K,目的是让烧瓶内压强和外界一致,待水沸腾时,关闭活塞K,开始蒸馏,若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即打开活塞K,和外界联通降低压强,B制取HF的装置,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢,用水蒸气蒸出,冷凝到D装置,被氢氧化钠中和吸收,在采用滴定法定量测定氟元素的质量分数。
(1)A的名称是圆底烧瓶,长导管用于平衡压强,实验过程中其下端在液面以下;
答案:圆底烧瓶 不能
(2)实验过程中,直形冷凝管中的冷却水应从a进b出,这样可使冷却水充满外管,有利于带走热量;
答案:b。
(3) 从实验安全角度考虑,实验时,首先打开活塞K,目的是让烧瓶内压强和外界一致,待水沸腾时,关闭活塞K,开始蒸馏,若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即打开活塞K,和外界联通降低压强;
答案:打开活塞K
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,石棉绳的隔热效果比较好,主要起到保温防止水蒸气冷凝的作用;
答案:保温,避免水蒸气冷凝。
(5)①根据题干知识可知反应原理为高沸点酸(难挥发性酸)制取低沸点酸(易挥发性酸),醋酸和硝酸易挥发,不可代替高氯酸;
答案:ab
②D中是氢氧化钠与HF发生酸碱中和生成盐和水,离子方程式为HF+OH-=F-+H2O;
答案:HF+OH-=F-+H2O。
(6)关系式法计算:设F-的物质的量为x
3F-~LaF3~ La3+ EDTA ~ La3+
3mol 1mol 1mol 1mol
x x/3 0.1mol/L×20.00×10-3L 0.1mol/L×20.00×10-3L
![]() +0.1mol/L×20.00×10-3L=0.100mol/L×25.00×10-3L
+0.1mol/L×20.00×10-3L=0.100mol/L×25.00×10-3L
得x=1.5×10-3mol=0.0015mol
氟化稀土样品中氟的质量分数为:![]() ×100%=2.85%
×100%=2.85%
答案:2.85%

 备战中考寒假系列答案
备战中考寒假系列答案