题目内容
【题目】下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.往等c(H+)和等体积的盐酸和醋酸中,分别加足量相同的锌片,相同状况下,与醋酸反应产生的气体体积更大
C.已知H2CO3 的 Ka1= 4.30×10-7,Ka2= 5.61×10-11,HClO的 Ka = 3.0×10-8,则反应CO2+H2O+2NaClO=Na2CO3+2HClO能够成立
D.等c(H+)的盐酸和醋酸,加水稀释100倍后,c(H+)前者大于后者
【答案】B
【解析】
A. 水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液为酸性或者碱性溶液,偏铝酸根离子能够与氢离子反应;
B. 醋酸是弱酸,所以当c(H+)相同时,醋酸物质的量浓度大,含溶质物质的量多,所以反应放出的氢气多;
C. 已知H2CO3 的Ka1= 4.30×10-7,Ka2= 5.61×10-11,HClO的Ka = 3.0×10-8,所以酸性:H2CO3>HClO>HCO3-,这个反应只能生成碳酸氢钠,不能生成碳酸钠,因为次氯酸的酸性介于碳酸和碳酸氢根离子之间,故C错误;
D. 相同c(H+)的盐酸、醋酸均稀释100倍后,盐酸中氢离子浓度都变为原先的![]() ,而醋酸为弱酸,稀释后醋酸的电离程度增大,醋酸中氢离子浓度大于原先溶液中氢离子浓度的
,而醋酸为弱酸,稀释后醋酸的电离程度增大,醋酸中氢离子浓度大于原先溶液中氢离子浓度的![]() ,所以稀释后溶液中c(H+)由大到小的顺序是:醋酸>盐酸,故D错误;
,所以稀释后溶液中c(H+)由大到小的顺序是:醋酸>盐酸,故D错误;
正确答案是B。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol):
2NH3(g) △H=-92.4kJ/mol):
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 1molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是( )
A.![]() >c3B.a + b=92.4C.P2>2P3D.α1 +α3>1
>c3B.a + b=92.4C.P2>2P3D.α1 +α3>1
【题目】青蒿素是从复合花序植物黄花蒿中提取得到的一种有效的疟疾治疗药物。查阅资料知:常温下,青蒿素为无色针状晶体,味道较苦,难溶于水,易溶于有机溶剂,熔点为![]() ;从青蒿中提取青蒿素的方法主要有乙醚浸提法和溶剂汽油浸提法。
;从青蒿中提取青蒿素的方法主要有乙醚浸提法和溶剂汽油浸提法。
回答下列问题:
(一)用乙醚浸提法提取青蒿素的流程如下图:

(1)对青蒿进行破碎的目的是______。
(2)操作Ⅰ所用到的玻璃仪器是______,操作Ⅱ的仪器选择及安装都正确的是______(填标号)。
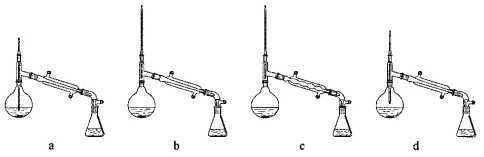
(3)操作Ⅲ的主要过程可能是______。
a.加水溶解,蒸发浓缩、冷却结晶
b.加95%乙醇,浓缩、结晶、过滤
c.加入乙醚进行萃取分液
(二)青蒿素分子式的测定
用如图所示的实验装置测定青蒿素的分子式,将28.2 g青蒿素放在燃烧管C中充分燃烧:
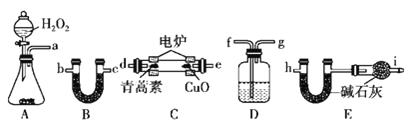
(4)①仪器各接口的连接顺序从左到右依次为______![]() 每个装置限用一次
每个装置限用一次![]() ;
;
②装置E中干燥管的作用是______;
③装置D中的试剂为______;
④已知青蒿素分子中只含碳、氢、氧三种元素,用合理连接后的装置进行实验,测量数据如表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素分子中碳、氢、氧三种原子的个数比为______。