题目内容
某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 (3分)
(2)沉淀丙中一定含有 (1分),可能含有 (1分)
(3)该溶液中肯定存在的离子有
(4)气体乙分子的结构式为
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为 ; ; (根据需要,可不填完,也可补充)
(1)至少含有CO32—、SO32—中的一种;一定不含有Fe3+ 、Cu2+、Ba2+;一定含有Na+(2)BaCO3;BaSO4(3)Na+、SO32—、AlO2—(4)O=C=O(5)HCO3—+H+=CO2↑+H 2O; Al3++3HCO3—=Al(OH)3↓+3CO2↑
解析试题分析:(1)通过实验①中,加入过量稀盐酸有气体产生,故溶液中至少含有CO32—、SO32—中的一种,若含有CO32—、SO32—中的一种,则,一定不能含有Fe3+ 、Cu2+、Ba2+。由于溶液中阴阳离子电荷守恒,故一定有阳离子为钠离子。(2)实验②中加入NH4HCO3溶液,得到气体乙,证明原溶液中一定不含有碳酸根,实验①中产生的气体甲为SO2,原溶液中一定含有SO32—。气体乙为二氧化碳。溶液甲中能够与NH4HCO3溶液产生白色沉淀乙只有Al3+。则产生的溶液乙中主要含有碳酸根,钠离子,碳酸氢根,氯离子,铵离子。但不能确定是否含有硫酸根离子。实验③中加入Ba(OH) 2产生的沉淀丙中一定含有BaCO3可能含有BaSO4。产生的气体丙为氨气。(3)通过上述可知,原溶液中一定含有Na+、SO32—、AlO2—三种离子。(4)气体乙为二氧化碳,故其分子结构式为O=C=O(5)甲溶液中含有的主要离子有H+、Al3+故可能发生的离子反应为HCO3—+H+=CO2↑+H 2O;Al3++3HCO3—=Al(OH)3↓+3CO2↑
考点:

 一线名师权威作业本系列答案
一线名师权威作业本系列答案 Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。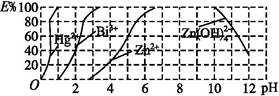
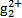 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H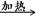 X+H2O+CO2↑
X+H2O+CO2↑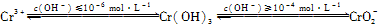
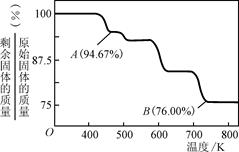
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2