题目内容
下列物质属于电解质的是 ;能导电的物质是 。
①氨水 ②蔗糖 ③烧碱 ④NH3·H2O ⑤CO2 ⑥铜
③④ ①⑥
解析试题分析:根据在水溶液或熔化状态下能否导电将化合物分为电解质和非电解质。识别注意两个要点:①必须为化合物②电解质包括的物质类别:酸、碱、盐、水、活泼金属氧化物。烧碱、NH3·H2O为碱,属于电解质;物质能否导电看其是否含有自由移动的带电微粒,铜中含有自由电子,氨水含有自由移动的NH4+和OH-,可以导电。
考点:考查电解质的概念及识别、物质的导电性判断。

在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有SiO32-? (填“有”或“没有”),判断理由是 。(用离子方程式表示)
(2)生成的气体中一定有 。它具有的性质是 (填字母序号)。
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
(3)原溶液中可能含有的阴离子是 。
(4)溶液中减少的离子是 ,原因是 (用离子方程式表示)。
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。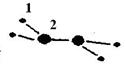
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) 写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A.2Na218O2 + 2H2O ="=" 4Nal8OH + O2↑ |
| B.NaH+D2O===NaOH+D2↑ |
| C.2KMnO4 + 5H218O2 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 518O2↑+ 8H2O |
| D.K37ClO3 + 6HCl ="=" K37Cl + 3Cl2↑+ 3H2O |
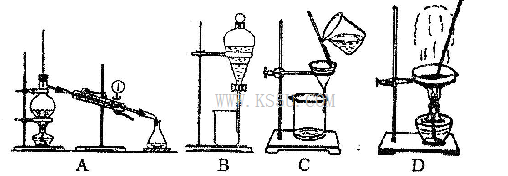
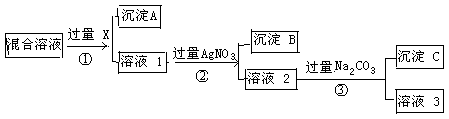

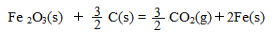 △H = +230 kJ/mol
△H = +230 kJ/mol