题目内容
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W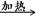 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
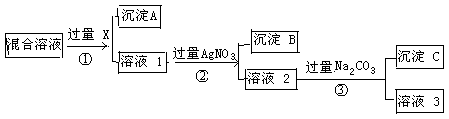
(1)W、X、Y、Z的化学式分别是:W:________、X:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:①离子方程式:__________________________。②化学方程式:_______________________。
(1)NaHCO3 Na2CO3 NaOH Na2O2
(2)②③ Na2O2 Na2O2 (3)Ca2++CO32-=CaCO3↓
Ca(OH)2+K2CO3=2KOH+CaCO3↓(其他合理答案也给分)
解析试题分析:W X+H2O+CO2↑,则W是碳酸氢钠,X是碳酸钠;Z+CO2―→X+O2,则Z是过氧化钠;Z+H2O―→Y+O2↑,则Y是氢氧化钠。
X+H2O+CO2↑,则W是碳酸氢钠,X是碳酸钠;Z+CO2―→X+O2,则Z是过氧化钠;Z+H2O―→Y+O2↑,则Y是氢氧化钠。
(1)W、X、Y、Z的化学式分别是NaHCO3、Na2CO3、NaOH、Na2O2。
(2)凡是有元素化合价升降的反应均是氧化还原反应,据此可知②Na2O2+CO2―→Na2CO3+O2、③Na2O2+H2O―→NaOH+O2↑氧元素的化合价发生变化,属于氧化还原反应,即答案选②③;其中均是过氧化钠中的氧元素发变化,即氧元素化合价部分从-1价升高到0价,部分降低到-2价,属于过氧化钠既是氧化剂,也是还原剂。
(3)碳酸钠和氢氧化钙反应的离子方程式为Ca2++CO32-=CaCO3↓;可溶性碳酸盐也能和氢氧化钙反应生成碳酸钙白色沉淀,例如Ca(OH)2+K2CO3=2KOH+CaCO3↓。
考点:考查钠化合物转化、氧化还原反应的有关判断以及方程式的书写

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
| A.容量瓶中原有少量蒸馏水 |
| B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中; |
| C.定容时观察液面俯视 |
| D.溶解后未经冷却立即转移至容量瓶内 |
______________________________________________.
Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们
的日常生产和生活。
已知:
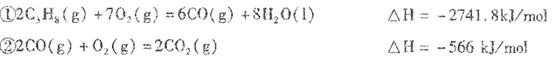
(1)反应
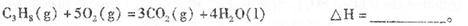
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________.
(3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。
 、
、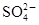 。为了进一步确认,取样进行实验检测:
。为了进一步确认,取样进行实验检测: