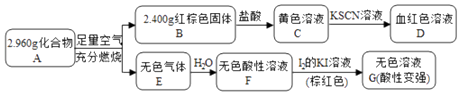
题目内容
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3﹣的反应原理如图1所示. 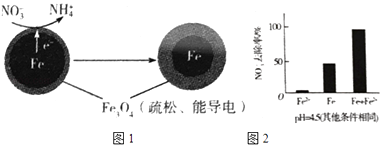
②作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: . pH=4.5(其他条件相同)
【答案】
(1)铁;NO3﹣+8e﹣+10H+=NH4++3H2O
(2)FeO(OH)不导电,阻碍电子转移
(3)本实验条件下,Fe2+不能直接还原NO3﹣;在Fe和Fe2+共同作用下能提高NO3﹣的去除率;Fe2++2FeO(OH)=Fe3O4+2H+ , Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4 , 利于电子转移
【解析】解:(1)①Fe还原水体中NO3﹣ , 则Fe作还原剂,失去电子,作负极,故答案为:铁;②NO3﹣在正极得电子发生还原反应产生NH4+ , 根据图2信息可知为酸性环境,则正极的电极反应式为:NO3﹣+8e﹣+10H+=NH4++3H2O,
故答案为:NO3﹣+8e﹣+10H+=NH4++3H2O;(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3﹣的去除率低.
故答案为:FeO(OH)不导电,阻碍电子转移;(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3﹣的去除率为0,因此得出Fe2+不能直接还原NO3﹣;而Fe和Fe2+共同加入时NO3﹣的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3﹣;在Fe和Fe2+共同作用下能提高NO3﹣的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3﹣;在Fe和Fe2+共同作用下能提高NO3﹣的去除率;②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4 , 离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+ , Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4 , 利于电子转移.
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+ , Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4 , 利于电子转移.
(1)①Fe还原水体中NO3﹣ , 根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;②NO3﹣在正极得电子发生还原反应产生NH4+ , 根据图2信息可知为酸性环境;(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;(3)①根据图2中的三个实验结果进行分析;②结合(2)题中的铁的最终物质形态结果差异进行分析.

 发散思维新课堂系列答案
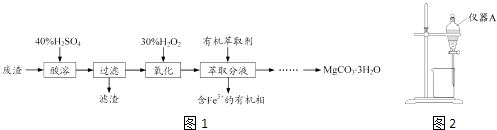
发散思维新课堂系列答案【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1: 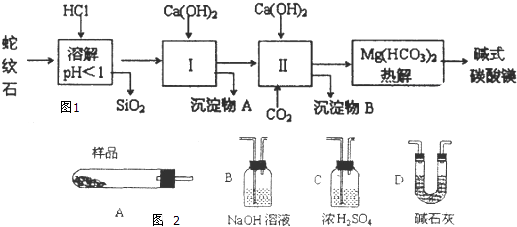
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .
(2)进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀.
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填所加物质的化学式),然后、、灼烧(填实验操作名称).灼烧操作需在中进行(填写仪器名称),上述实验中,可以循环利用的物质是(填化学式).
(4)现设计实验,确定产品aMgCO3bMg(OH)2cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④ , ⑤称量MgO的质量.
(5)从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置(选择仪器代号,可重复使用,用“A→B→…→”表示)
(6)18.2g产品完全分解后.产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中 a= , b= , c= .