��Ŀ����
����Ŀ�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ����̽������ɣ� 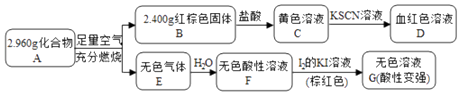
��ش�
��1��A�Ļ�ѧʽΪ �� A��������B��E�Ļ�ѧ����ʽΪ ��
��2����ҺC���ܽ�ͭƬ����Ӧ�����ӷ���ʽΪ �� ���ٸ÷�Ӧ��һ��ʵ��Ӧ����
��3����֪������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ�����壨����µ��ܶ�Ϊ1.518g/L������������ӵĵ���ʽΪ �� �÷�Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1��Fe3S4��4Fe3S4+25O2 ![]() 6Fe2O3+16SO2
6Fe2O3+16SO2
��2��2Fe3++Cu=2Fe2++Cu2+������ͭ��·��
��3��![]() ��Fe3S4+6H+=3Fe2++S+3H2S��
��Fe3S4+6H+=3Fe2++S+3H2S��
���������⣺��1�������Ϸ�����֪��AΪFe3S4 �� BΪFe2O3 �� EӦΪSO2 �� ��A��������B��E�Ļ�ѧ����ʽΪ4Fe3S4+25O2 ![]() 6Fe2O3+16SO2 �� ���Դ��ǣ�Fe3S4��4Fe3S4+25O2
6Fe2O3+16SO2 �� ���Դ��ǣ�Fe3S4��4Fe3S4+25O2 ![]() 6Fe2O3+16SO2����2�������Ϸ�����֪����ҺCΪFeCl3 �� ������ͭ�������ڿ���ͭ��·�壬��Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+ ��
6Fe2O3+16SO2����2�������Ϸ�����֪����ҺCΪFeCl3 �� ������ͭ�������ڿ���ͭ��·�壬��Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+ ��
���Դ��ǣ�2Fe3++Cu=2Fe2++Cu2+������ͭ��·�壻��3��������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ�����壨����µ��ܶ�Ϊ1.518gL��1��������ɫ������ΪS���������Է�������Ϊ1.518��22.4L=34��ΪH2S���壬����ʽΪ ![]() ����Ӧ�����ӷ���ʽΪFe3S4+6H+=3Fe2++S+3H2S����
����Ӧ�����ӷ���ʽΪFe3S4+6H+=3Fe2++S+3H2S����
���Դ��ǣ� ![]() ��Fe3S4+6H+=3Fe2++S+3H2S����
��Fe3S4+6H+=3Fe2++S+3H2S����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��
��1��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ1��ʾ�� 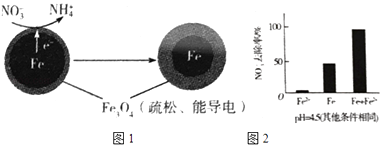
���������������� ��
�������ĵ缫��Ӧʽ�� ��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3����ȥ���ʺ�pH����������
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3����ȥ���ʵͣ���ԭ���� ��
��3��ʵ�鷢�֣��ڳ�ʼpH=4.5��ˮ����Ͷ���������۵�ͬʱ������һ������Fe2+�����������NO3����ȥ���ʣ���Fe2+������������ּ��裺
��Fe2+ֱ�ӻ�ԭNO3����
��Fe2+�ƻ�FeO��OH�������㣮
�����Ա�ʵ�飬�������ͼ2��ʾ���ɵõ��Ľ����� ��
��ͬλ��ʾ�ٷ�֤ʵFe2+����FeO��OH����Ӧ����Fe3O4 �� ��ϸ÷�Ӧ�����ӷ���ʽ�����ͼ���Fe2+���NO3��ȥ���ʵ�ԭ�� �� pH=4.5������������ͬ��
����Ŀ��ij��Һ�к��д�����Cl����Br����I�� �� ����1L�û����Һ��ͨ��һ������Cl2 �� ��Һ��Cl����Br����I�������ʵ�����ͨ��Cl2���������״�����Ĺ�ϵ���±���ʾ��ԭ��Һ��Cl����Br����I�������ʵ���Ũ��֮��Ϊ��������
Cl2���������״���� | 5.6L | 11.2L | 22.4L |
n��Cl����/mol | 1.5 | 2.0 | 3.0 |
n��Br����/mol | 3.0 | 2.8 | 1.8 |
n��I����/mol | x��x��0�� | 0 | 0 |
A.5��15��4
B.5��12��4
C.15��30��8
D.�������㣬������



