题目内容
【题目】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3 , Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为 , 该元素的符号是 .
(2)Y元素原子的价层电子的轨道表示式为 .
(3)X与Z可形成化合物XZ3 , 该化合物的空间构型为 .
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低 , 理由是 .
(5)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3 , 产物还有ZnSO4和H2O,该反应的化学方程式是 .
【答案】
(1)1s22s22p63s23p63d104s24p3;As
(2)![]()
(3)三角锥形
(4)低;键长N﹣H<P﹣H<As﹣H,键长越短,键能越大,化合物越稳定
(5)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
【解析】解:X元素原子的4p轨道上有3个未成对电子,原子的核外电子排布式为 1s22s22p63s23p63d104s24p3 , 处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3 , 故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42﹣8﹣33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意.(1)X元素原子的4p轨道上有3个未成对电子,由能量最低原理原理,可知原子的核外电子排布式为 1s22s22p63s23p63d104s24p3 , 故X为As, 所以答案是:1s22s22p63s23p63d104s24p3;As;(2)Y为O元素,价电子排布式为2s22p4 , 则价电子排布图为: ![]() ,
,
所以答案是: ![]() ;(3)X与Z可形成化合物AsH3 , 与氨气结构相似,该化合物的空间构型为三角锥形,
;(3)X与Z可形成化合物AsH3 , 与氨气结构相似,该化合物的空间构型为三角锥形,
所以答案是:三角锥形;(4)X为As元素,AsH3与NH3、PH3中,键长N﹣H<P﹣H<As﹣H,键长越短,键能越大,化合物稳定,
所以稳定性NH3>PH3>AsH3 ,
所以答案是:低;键长N﹣H<P﹣H<As﹣H,键长越短,键能越大,化合物越稳定;(5)化合物X2Y3为As2O3 , XZ3为AsH3 , As2O3在稀硫酸溶液中可被金属锌还原为AsH3 , 产物还有ZnSO4和H2O,反应中Zn元素化合价由0价升高为+2价,As元素化合价由+3价降低为﹣3价,参加反应的Zn与As2O3的物质的量之比为6×2:2=6:1,反应方程式为As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O.
所以答案是:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O.

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3﹣的反应原理如图1所示. 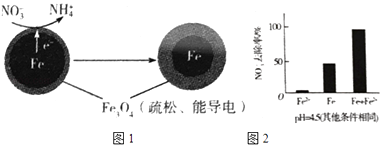
②作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: . pH=4.5(其他条件相同)
【题目】某溶液中含有大量的Cl﹣、Br﹣、I﹣ , 若向1L该混合溶液中通入一定量的Cl2 , 溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为( )
Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
n(Cl﹣)/mol | 1.5 | 2.0 | 3.0 |
n(Br﹣)/mol | 3.0 | 2.8 | 1.8 |
n(I﹣)/mol | x(x>0) | 0 | 0 |
A.5:15:4
B.5:12:4
C.15:30:8
D.条件不足,无法计算

