题目内容
17. 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.(1)利用反应CH4+2NO2 $\frac{\underline{\;催化剂\;}}{\;}$N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是NO2,当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理1molNO2.
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体.该反应的化学方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色.
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀.
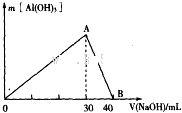
Ⅲ.取100mL废水,逐滴加入1.0mol•L-1的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如图所示.
请根据上述信息回答下列问题:
①该废水中一定不含有的离子是Fe3+、Na+、OH-.
②实验中需配制1.0mol•L-1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有100mL容量瓶.
③写出图中A→B反应的离子方程式:OH-+Al(OH)3=AlO2-+2H2O.
④通过计算,该废水中含有Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=0.1mol/L(若不含有,此问不必作答).
分析 (1)根据元素化合价的变化来判断氧化剂的化合价降低;根据反应方程式分析判断;
(2)在催化剂条件下NO和CO反应,生成CO2和N2;
(3)无色废水中不含Fe3+,
I.进行焰色反应实验,火焰为无色,说明无钠离子;
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀,说明溶液中含有硫酸根离子,而且物质的量为0.01mol;
Ⅲ.取100mL废水,逐滴加入1.0mol•L-1的NaOH溶液,说明溶液中含有铝离子,而铝离子的物质的量为:$\frac{×0.03}{3}$=0.01mol,由此分析解答.
解答 解:(1)二氧化氮中氮由+4价变成0价,所以二氧化氮是氧化剂,据反应CH4+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+CO2+2H2O可知1mol的甲烷消耗2mol的二氧化氮,所以当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理1molNO2,故答案为:NO2;1;
(2)在催化剂条件下NO和CO反应,生成CO2和N2,反应的方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(3)无色废水中不含Fe3+,
Ⅱ.取100mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀,说明溶液中含有硫酸根离子,而且物质的量为0.01mol;
Ⅲ.取100mL废水,逐滴加入1.0mol•L-1的NaOH溶液,说明溶液中含有铝离子,而铝离子的物质的量为$\frac{1×0.03}{3}$=0.01mol,有铝离子就不含氢氧根离子,根据电荷守恒,含有氯离子,n(Cl-)=3n(Al3+)-2n(SO42-)=3×0.01-2×0.01=0.01mol,则:
①该废水中一定不含有的离子是Fe3+、Na+、OH-,故答案为:Fe3+、Na+、OH-;
②实验中需配制1.0mol•L-1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有100ml的容量瓶,故答案为:100mL容量瓶;
③图中A→B反应是氢氧化铝溶解生成偏铝酸钠,离子方程方程式为:OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;
④根据电荷守恒,该废水中含有Cl-;则c(Cl- )=$\frac{0.01}{0.1}$=0.1mol•L-1,故答案为:含有;0.1mol•L-1..
点评 本题主要考查氧化还原反应的计算,化学方程式的书写,离子共存的判断与计算.

| A. | 银氨溶液、浓溴水 | B. | 酸性高锰酸钾溶液、氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液、浓溴水 | D. | 氯化铁溶液、浓溴水 |
| A. | ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的电负性随原子序数增大而递增的是④ | |
| B. | 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4对应的第一电离能最大的是④ | |
| C. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素在第三周期第 IIA族 | |
| D. | 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22 s22p63s23p4半径最大的是① |
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)当升高温度时,K值变大,向各弱酸溶液中滴加少量NaOH溶液,K值不变(以上选填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系在相同条件下K值越大,电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②在过量的氯水中滴入少量的碳酸钠溶液2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
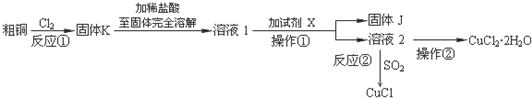
 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.

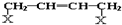
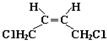

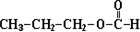 和
和 

 _
_
 $\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙
$\overrightarrow{②}$X $→_{③△}^{NaOH醇溶液}$乙 (注明反应条件).
(注明反应条件). ).写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式
).写出同时符合①能发生银镜反应;②能与FeCl3溶液发生显色反应;③核磁共振氢谱图上产生4个吸收峰等要求的丙的同分异构体结构简式 、
、 .
.