题目内容
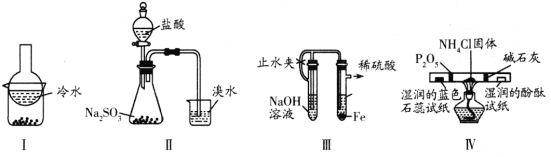
【题目】如图是产生和收集气体的实验装置,该装置适合于( )

A.用浓硝酸与Cu反应制取NO2B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2D.用NH4Cl和Ca (OH)2反应制取NH3
【答案】C
【解析】
A.铜与浓硝酸反应生成二氧化氮,实验为固体和液体常温下反应生成气体实验,且二氧化氮难溶于水,不能用排水法收集,需用向上排空气法收集,故A错误;
B.用浓盐酸和二氧化锰反应制取氯气需要加热,发生装置错误,氯气可与水反应,不可用排水法收集,需用排饱和食盐水收集,故B错误;
C.用H2O2溶液和MnO2反应制取O2属于固液常温型,氧气难溶于水,可用排水法收集,故C正确;
D.氯化铵和氢氧化钙是固体,反应需要加热,所以反应应该在试管中进行,且试管口略向下倾斜,发生装置错误;氨气极易溶于水,不可用排水法收集,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为________,SO42-中S原子轨道的杂化类型为________。
(2)二价锰的3种离子化合物的熔点如下表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是________。
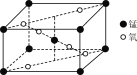
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为________。
(4)在化合物K3[Mn(CN)6]中,微粒之间存在的作用力有________(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
(5)制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4∶1的物质的量之比配料,球磨3~5 h,然后升温,高温加热,保温24 h,冷却至室温。写出该反应的化学方程式:____________。
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。

请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是_________(填字母序号)。
A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为____________________。
(3)实验过程中,SO42-_________(填“从左向右”、“从右向左”或“不”)移动;
滤纸上能观察到的现象有___________________。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH___________(填“增大” 、“减小”或“不变”)。电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O 和_______________。
(5)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
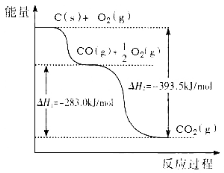
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
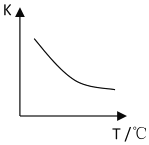
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。