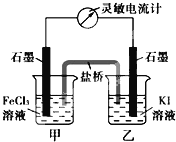
题目内容
【题目】根据下图所给信息,得出的结论正确的是
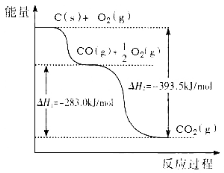
A.48g碳完全燃烧放出热量为1574 kJ/mol
B.2C(s)+O2(g)![]() 2CO(g) △H=-221.0kJ/mol
2CO(g) △H=-221.0kJ/mol
C.2CO2(g)![]() 2CO(g)+O2(g) △H=+283.0kJ/mol
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g)![]() CO2(s) △H=-393.5kJ/mol
CO2(s) △H=-393.5kJ/mol
【答案】B
【解析】
试题A.根据图示可知,1mol的C完全燃烧放出热量是393.5KJ,则48g碳也就是4mol的碳完全燃烧放出热量为393.5KJ /mol×4=1574 kJ,错误;B.1mol的 C燃烧变为CO,放热为393.5KJ-283KJ=110. 5KJ,则2mol的C燃烧变为CO放出热量是:110. 5KJ×2=221.0kJ,所以有热化学方程式2C(s)+O2(g)== 2CO(g) △H=-221.0kJ/mol,正确;C.根据图示可知1mol的CO2比1mold CO和1/2mold O2的能量低283.0kJ,则相应的热化学方程式是2CO2(g)== 2CO(g)+O2(g) △H=+566.0kJ/mol,错误;D.1mol的固体C完全燃烧产生1mol的气体CO2,放出热量是393.5kJ ,由于物质在固体含有的能量比气态低,所以产生1魔力岛固态CO2放出的热量要比393.5kJ 多,因此该热化学方程式书写有误,错误。

【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。

实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱