题目内容
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
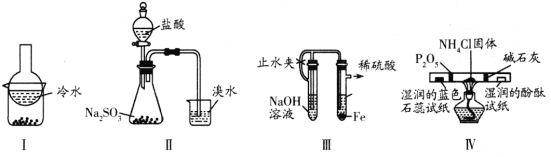
A. 加热装置Ⅰ中的烧杯分离I2和高锰酸钾固体
B. 用装置Ⅱ验证二氧化硫的漂白性
C. 用装置Ⅲ制备氢氧化亚铁沉淀
D. 用装置Ⅳ检验氯化铵受热分解生成的两种气体
【答案】D
【解析】
高锰酸钾固体受热会分解;二氧化硫使品红等有机物褪色是二氧化硫的漂白性;硫酸亚铁溶液与氢氧化钠溶液不能自动混合;氯化铵受热分解生成氨气、氯化氢气体,用酸碱指示剂分别检验。
A项:加热时混合物中的碘升华、碘蒸气遇冷凝华,但高锰酸钾固体会分解,故装置I不能分离I2和高锰酸钾固体,A项错误;
B项:装置Ⅱ中锥形瓶内生成的二氧化硫能使烧杯内溴水褪色,这是二氧化硫的还原性而不是漂白性,B项错误;
C项:装置Ⅲ中,右边试管内生成硫酸亚铁溶液和氢气,氢气排出装置,硫酸亚铁溶液与左边试管内氢氧化钠溶液不能自动混合,不能制备氢氧化亚铁沉淀,C项错误;
D项:装置Ⅳ中,氯化铵受热分解生成氨气、氯化氢的混合气体,P2O5吸收氨气,湿润的蓝色石蕊试纸检验氯化氢。碱石灰吸收氯化氢,湿润的酚酞试纸检验氨气,D项正确。
本题选D。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目