题目内容
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为________,SO42-中S原子轨道的杂化类型为________。
(2)二价锰的3种离子化合物的熔点如下表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是________。
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为________。

(4)在化合物K3[Mn(CN)6]中,微粒之间存在的作用力有________(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
(5)制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4∶1的物质的量之比配料,球磨3~5 h,然后升温,高温加热,保温24 h,冷却至室温。写出该反应的化学方程式:____________。
【答案】1s22s22p63s23p63d5 sp3 MnO MnO2 abc 8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑
4LiMn2O4+2CO2↑+O2↑
【解析】
(1)Mn是25号元素,核外电子排布式为1s22s22p63s23p63d54s2,Mn2+基态的电子排布式为1s22s22p63s23p63d5;
SO42-中S原子的价层电子数=4+![]() (6+2-3×2)=4,所以采取sp3杂化方式;
(6+2-3×2)=4,所以采取sp3杂化方式;
(2)三种物质都是离子晶体,离子半径越小,离子键就越强,离子晶体的晶格能就越大,物质的熔点就越高,根据表格数据可知上表三种物质中晶格能最大的是MnO;
(3)在该晶体中含有的Mn原子个数为8×![]() +1=2,含有的O原子数目为:4×
+1=2,含有的O原子数目为:4×![]() +2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;
+2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;
(4)K3[Fe(CN)6]是配位化合物,也是离子化合物,则该化合物中一定存在配位键、离子键,C、N之间存在极性共价键,所以存在的作用力有abc;
(5)MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成.该反应的方程式为:8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑。
4LiMn2O4+2CO2↑+O2↑。

 作业辅导系列答案
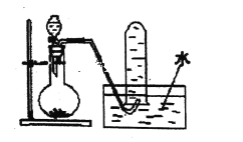
作业辅导系列答案【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。

实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱