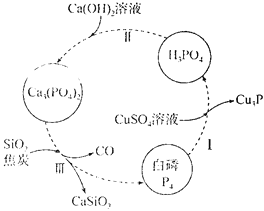
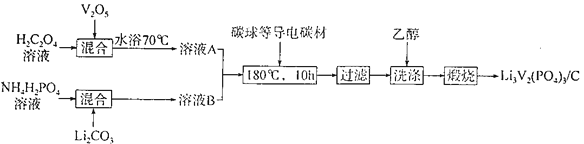
题目内容
【题目】MOH和ROH两种一元碱的溶液分别加水稀释,pH变化如图。下列叙述中不正确的是( )

A. ROH是一种强碱
B. 在x点,MOH已完全电离
C. 在x点C(M+)=C(R+)
D. 稀释前C(ROH) = 10 C(MOH)
【答案】BD
【解析】
根据图中信息,稀释100倍时,ROH溶液的PH由13降到11,说明ROH为一元强碱;MOH溶液的PH由12降到11,说明MOH为一元弱碱。
A.根据以上分析可知,ROH是一种强碱,故A正确;
B.根据以上分析可知,MOH是一元弱碱,不可能完全电离,故B错误;
C.利用电荷守恒C(M+)=C(OH)-C(H+), C(R+)=C(OH)-C(H+),由于两种溶液在x点PH相同,所以OH-与H+的浓度相同,所以C(M+)=C(R+),故C正确;
D.稀释前ROH溶液的PH为13,C(R+)=-0.1mol/l,MOH溶液的PH为12,但MOH为弱碱,C(M+)>0.01mol/l,则C(ROH)< 10C(MOH),故D错误;
正确答案:BD。

练习册系列答案
相关题目