题目内容
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
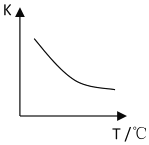
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
【答案】0.1mol/(Lmin) ![]() 小于 变大 亚硫酸被氧化成硫酸,酸性增强,pH减小 ②>①>③ H2SO3H++HSO3-、HSO3-H++SO32-,滴加氨水后,中和电离出的H+,导致电离平衡正向移动,SO32-浓度增大,产生BaSO3沉淀
小于 变大 亚硫酸被氧化成硫酸,酸性增强,pH减小 ②>①>③ H2SO3H++HSO3-、HSO3-H++SO32-,滴加氨水后,中和电离出的H+,导致电离平衡正向移动,SO32-浓度增大,产生BaSO3沉淀
【解析】
(1)根据方程式6NO2(g)+8NH3(g)7N2(g)+12H2O(g)知,如果有8mol氨气完全反应,则反应前后混合物增加的物质的量为5mol,则如果反应混合物的物质的量增加了0.25mol,则消耗n(NH3)=![]() =0.4mol,则2min内v(NH3)=
=0.4mol,则2min内v(NH3)=![]() =
=![]() mol/(L.min)=0.1mol/(Lmin);
mol/(L.min)=0.1mol/(Lmin);
(2)化学平衡常数K=![]() ;升高温度平衡常数减小,平衡逆向移动,则逆反应速率大于正反应速率,所以v正反应小于v逆反应;缩小体积相当于增大压强,平衡向逆反应方向移动,导致气体的物质的量减小,但是气体总质量不变,所以混合气体平均式量变大;
;升高温度平衡常数减小,平衡逆向移动,则逆反应速率大于正反应速率,所以v正反应小于v逆反应;缩小体积相当于增大压强,平衡向逆反应方向移动,导致气体的物质的量减小,但是气体总质量不变,所以混合气体平均式量变大;
(3)二氧化硫和水反应生成亚硫酸,亚硫酸不稳定,易被空气氧化生成硫酸,亚硫酸是弱酸、硫酸是强酸,所以溶液酸性增强,pH减小,
故答案为:亚硫酸被氧化成硫酸,酸性增强,pH减小;
(4)盐水解程度越大,水的电离程度越大;NH4+和HCO3-相互促进水解,H+抑制NH4+水解,所以水解程度②>①>③,水的电离程度②>①>③;
(5)H2SO3H++HSO3-、HSO3-H++SO32-,滴加氨水后,中和电离出的H+,导致电离平衡正向移动,SO32-浓度增大,产生BaSO3沉淀。

【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出元素A名称______,元素B符号________,E原子电子式________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是___________,生成物的化学式为___________
(4)A与E形成的化合物的电子式为__________,它的性质决定了它在物质的分类中应属于____________(酸性氧化物/碱性氧化物/两性氧化物)
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_________,写出化合物DE与过量烧碱反应的化学反应方程式________。
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%




