题目内容
15.已知H2S的一级和二级电离平衡常数分别为Ka(H2S)=9.1×10-8,Ka(HS-)=1.1×10-12•0.1mol•L-1的Na2S的水解程度约为52%,则有关0.1mol•L-1的Na2S溶液的说法正确的是( )| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
分析 A.任何电解质溶液中都存在质子守恒;
B.硫离子存在两步水解,第一步水解程度远远大于第二步水解,钠离子不水解;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.硫化钠水解导致溶液呈碱性,所以配制硫化钠溶液时要加入碱抑制其水解,但不能引进杂质.
解答 解:A.任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B.硫离子存在两步水解,第一步水解程度远远大于第二步水解,钠离子不水解,且两步水解都生成氢氧根离子,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+),故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得 c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),故C错误;
D.硫化钠水解导致溶液呈碱性,所以配制硫化钠溶液时要加入碱抑制其水解,但不能引进杂质,所以应该加入NaOH溶液,故D错误;
故选B.
点评 本题以盐类水解为载体考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,结合原子守恒、物料守恒、质子守恒解答,易错选项是B,注意题干中已经明确“Na2S的水解程度约为52%”,说明溶液中c(HS-)>c(S2-),为易错点.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
5.以0.10mol/L的氢氧化钠溶液滴定某一元弱酸HA的滴定曲线如图所示.下列表述正确的是( )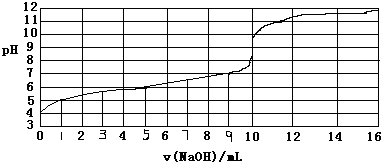

| A. | 此实验可以选用酚酞作指示剂 | |
| B. | 弱酸HA的浓度约为1×10-4mol/L | |
| C. | 根据已知条件,弱酸HA的电离常数(Ka)不能计算 | |
| D. | 当NaOH体积为9ml时,恰好完全中和反应 |
6.100℃时,水的离子积为5.5×10-13,则此温度时纯水呈( )
| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |
3.下列各表述与示意图一致的是( )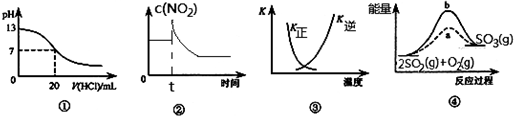

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
10.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且含锰元素的化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.336L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,充分反应后生成氯气的体积是(气体体积都在标准状况下测定)( )
| A. | 1.344L | B. | 1.568L | C. | 1.792L | D. | 2.016L |
4.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中.理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
5. 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
 溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下: 、
、 ;
; ;
;