题目内容
10.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且含锰元素的化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.336L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,充分反应后生成氯气的体积是(气体体积都在标准状况下测定)( )| A. | 1.344L | B. | 1.568L | C. | 1.792L | D. | 2.016L |
分析 KMnO4加热分解会得到K2MnO4、MnO2、O2,冷却后放入足量的浓盐酸再加热,Mn元素最终都以MnCl2形式存在,纵观整个过程,根据电子转移守恒,可知Mn元素获得电子等于O元素、Cl元素失去电子,据此计算生成氯气物质的量,进而计算氯气体积.
解答 解:6.32g KMnO4粉末物质的量=6.32g158g/mol6.32g158g/mol=0.04mol,氧气物质的量为0.336L22.4L/mol0.336L22.4L/mol=0.015mol,
KMnO4加热分解会得到K2MnO4、MnO2、O2,冷却后放入足量的浓盐酸再加热,Mn元素最终都以MnCl2形式存在,纵观整个过程,根据电子转移守恒,可知Mn元素获得电子等于O元素、Cl元素失去电子,则:
0.04mol×(7-2)=0.015mol×4+2×n(Cl2),解得n(Cl2)=0.07mol,
V(Cl2)=0.07mol×22.4L/mol=1.568L,
故选B.
点评 本题考查氧化还原反应的有关计算,难度中等,注意利用电子转移守恒解答,也可以利用方程式计算,但相对比较繁琐.

练习册系列答案
相关题目
20.已知1mol氢气完全燃烧生成水蒸气时放出242kJ的能量,且氧气中1mol O═O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H-O键形成时放出463kJ的能量,则氢气中1mol H-H键断裂时吸收的能量为( )
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
1.化学与生产、生活息息相关,下列说法正确的是( )
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海洋中含有丰富的矿产资源,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 加热可杀灭中东呼吸综合征(MERS)冠状病毒,因为病毒的蛋白质受热变性 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
18.下列说法正确的是( )
| A. | 分子晶体中都存在共价键 | B. | 在单质的晶体中一定不存在阴离子 | ||
| C. | 离子晶体中只有离子键 | D. | 干冰和冰中作用力完全相同 |
5.下列事实与胶体性质关的是( )
| A. | 工业生产中常用静电除尘装置除去废气中的固体悬浮物 | |
| B. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| C. | 一束平行光线照射豆浆时,可看到光亮的通路 | |
| D. | 万里长江流入大海处,形成长江三角洲 |
15.已知H2S的一级和二级电离平衡常数分别为Ka(H2S)=9.1×10-8,Ka(HS-)=1.1×10-12•0.1mol•L-1的Na2S的水解程度约为52%,则有关0.1mol•L-1的Na2S溶液的说法正确的是( )
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
2.辽宁舰航母入列到中国海军极大提升了中国的军心、民心,我国的国防从此又多了一把利器.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 通电_4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 通电_4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
| 金属离子 | Fe2+ | Fe3+ | Al3- | Mg2+ | Ni2+ |
| 开始沉淀的pH值 | 6.5 | 1.6 | 3.4 | 9.4 | 7.2 |
| 完全沉淀的pH值 | 9.7 | 3.2 | 5.4 | 12.4 | 9.3 |
20.下列实验装置及描述正确的是( )
| A. |  该图装置不能这么碳酸与苯酚的酸性强弱 | |
| B. | 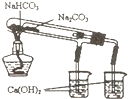 该图可验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 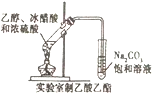 实验室可用该装置制取少量的乙酸乙酯 | |
| D. | 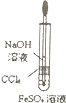 该图装置可用于制备Fe(OH)2 |