题目内容
7.A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子半径最小;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族.回答下列问題:(1) 在六种元素中,形成物质种类最多的是碳(填元素名称);
(2) 写出C元素所有的氢化物的电子式
 、
、 ;
;(3) 用电子式表示D2F•的形成过程
 ;
;(4) 写出E与烧碱溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 A、B、C、D、E、F六种短周期元素的原子序数依次增大,①A原子半径最小,则A为H元素;②B原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,原子只能有2个电子层,最外层电子数为4,故B为碳元素;③C原子最外层电子数比次外层电子数多4个,最外层电子数不超过8个,原子只能有2个电子层,最外层电子数为6,故C为O元素;④D原子的次外层电子数是最外层电子数的8倍,最外层电子数只能为1,则D为Na;⑤E单质既能和盐酸反应又能和烧碱反应,则E为Al;⑥F与C同主族,则F为S元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素的原子序数依次增大,①A原子半径最小,则A为H元素;②B原子最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,原子只能有2个电子层,最外层电子数为4,故B为碳元素;③C原子最外层电子数比次外层电子数多4个,最外层电子数不超过8个,原子只能有2个电子层,最外层电子数为6,故C为O元素;④D原子的次外层电子数是最外层电子数的8倍,最外层电子数只能为1,则D为Na;⑤E单质既能和盐酸反应又能和烧碱反应,则E为Al;⑥F与C同主族,则F为S元素.
(1)在六种元素中,碳元素形成有机物,形成物质种类最多,故答案为:碳;
(2)C元素的氢化物由H2O、H2O2,电子式分别为 、
、 ,故答案为:
,故答案为: ;
; ;
;
(3)用电子式表示Na2S的形成过程为: ,
,
故答案为: ;
;
(4)Al与烧碱溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,侧重对化学用语的考查,注意掌握用电子式表示物质或化学键的形成,难度中等.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
17.下列叙述正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 工业上以石油为原料生产乙烯 | |
| C. | 油脂不是酯 | |
| D. | 充分燃烧后只生成CO2和H2O的有机物就是烃 |
18.下列说法正确的是( )
| A. | 分子晶体中都存在共价键 | B. | 在单质的晶体中一定不存在阴离子 | ||
| C. | 离子晶体中只有离子键 | D. | 干冰和冰中作用力完全相同 |
15.已知H2S的一级和二级电离平衡常数分别为Ka(H2S)=9.1×10-8,Ka(HS-)=1.1×10-12•0.1mol•L-1的Na2S的水解程度约为52%,则有关0.1mol•L-1的Na2S溶液的说法正确的是( )
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
2.辽宁舰航母入列到中国海军极大提升了中国的军心、民心,我国的国防从此又多了一把利器.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 通电_通电–––––4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
(1)航母升降机可由铝合金制造.
①铝合金硬度较纯铝的硬度大(填“大”或“小”).工业炼铝的原料由铝土矿提取而得,写出电解氧化铝炼铝的化学方程式2Al2O3 通电_通电–––––4Al+3O2↑.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,焊接过程汇总使用的保护气为Ar(填化学式).
(2)航母舰体为合金钢.
①舰体在海水中发生的电化学腐蚀的类型主要为吸氧腐蚀,写出此类腐蚀的正极反应式O2+4e-+2H2O=4OH-.
②舰母用钢由生铁冶炼而成,在炼钢过程中为降低生铁中碳的含量需加入的物质为氧气(或氧化亚铁等).
(3)舰母螺旋桨主要用铜合金制造.
①80.0Cu•Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为83.1%(保留一位小数).
②某些金属离子形成氢氧化物沉淀的Ph如下表所示,为分析某铜合金的成分,用酸 将其完全溶解后,用NaOH溶液调pH.当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合表中信息推断该合金中除铜外一定含有Al、Ni.
| 金属离子 | Fe2+ | Fe3+ | Al3- | Mg2+ | Ni2+ |
| 开始沉淀的pH值 | 6.5 | 1.6 | 3.4 | 9.4 | 7.2 |
| 完全沉淀的pH值 | 9.7 | 3.2 | 5.4 | 12.4 | 9.3 |
12.X、Y、Z、W、M均为短周期元素且原子序数依次增大,X、M同主族;Z+、W3+与Y2-具有相同的电子层结构;M 是地壳中含量占第二的元素.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 粒子半径:r(W3+)>r(Y2-)>r(Z+) | ||
| C. | MY2与Z2Y的化合物类型相同 | D. | 单质沸点:M>Z>Y |
17.下列反应的离子方程式书写正确的是( )
| A. | 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-═2Fe2++I2 | |
| B. | 含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | CaCO3溶于醋酸:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+2H2O | |
| D. | 向海带灰浸出液中加入硫酸、双氧水:2I-+H2O2═2OH-+I2 |
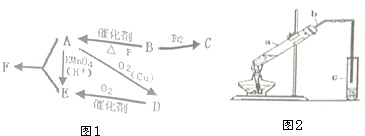 有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:
有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题: