题目内容
6.100℃时,水的离子积为5.5×10-13,则此温度时纯水呈( )| A. | 酸性 | B. | 碱性 | C. | 中性 | D. | 无法判断 |
分析 如果溶液中存在c(OH-)=c(H+),则溶液呈中性;如果存在c(OH-)>c(H+),溶液呈碱性;如果存在c(OH-)<c(H+),溶液呈酸性,据此分析解答.
解答 解:如果溶液中存在c(OH-)=c(H+),则溶液呈中性;如果存在c(OH-)>c(H+),溶液呈碱性;如果存在c(OH-)<c(H+),溶液呈酸性,任何温度下纯水中都存在c(OH-)=c(H+),100℃时,纯水中存在c(OH-)=c(H+),所以此温度纯水呈中性,故选C.
点评 本题以水为载体考查溶液酸碱性判断,温度越高水的离子积常数越大,但溶液酸碱性与c(OH-)、c(H+)的相对大小有关,与离子积常数大小无关,为易错点.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
16.下列说法正确的是( )
| A. | NaHCO3 是强电解质,BaCO3 是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.05 mol•L-1醋酸溶液加水稀释时,c(H+)变小 |
17.下列叙述正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 工业上以石油为原料生产乙烯 | |
| C. | 油脂不是酯 | |
| D. | 充分燃烧后只生成CO2和H2O的有机物就是烃 |
1.化学与生产、生活息息相关,下列说法正确的是( )
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海洋中含有丰富的矿产资源,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 加热可杀灭中东呼吸综合征(MERS)冠状病毒,因为病毒的蛋白质受热变性 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
11.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | P、S、Cl最高正价依次降低 | |
| C. | HCl、HBr、HI的稳定性依次增强 | |
| D. | 钠、镁、铝的金属性依次减弱 |
18.下列说法正确的是( )
| A. | 分子晶体中都存在共价键 | B. | 在单质的晶体中一定不存在阴离子 | ||
| C. | 离子晶体中只有离子键 | D. | 干冰和冰中作用力完全相同 |
15.已知H2S的一级和二级电离平衡常数分别为Ka(H2S)=9.1×10-8,Ka(HS-)=1.1×10-12•0.1mol•L-1的Na2S的水解程度约为52%,则有关0.1mol•L-1的Na2S溶液的说法正确的是( )
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
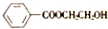 )和N(
)和N(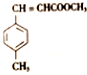 )
)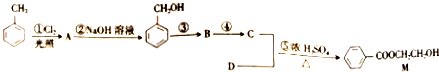
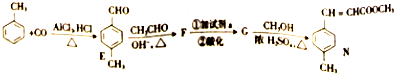
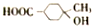 )是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).
)是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).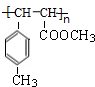 .
.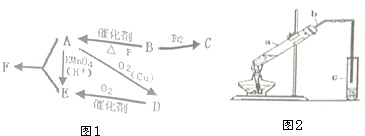 有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:
有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题: