题目内容
4.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中.理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
分析 “绿色化学”原子经济反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,加成反应和加聚反应符合要求.
解答 解:A.苯与氢气发生加成反应制备环己烷,该反应为加成反应,原料利用率为100%,故A正确;
B.甲烷与氯气制备一氯甲烷,属于取代反应,伴随副反应,反应物没全部转化为所需产物,故B错误;
C、以铜和浓硝酸为原料生产硝酸铜,因有有毒气体二氧化氮生成,反应物没全部转化为所需产物,故C错误;
D.苯与硝酸反成制备硝基苯,有副产品水生成,反应物没全部转化为所需产物,故D错误.
故选A.
点评 本题考查“绿色化学”知识,难度不大,要熟悉各种反应类型,还要考虑环保、经济等方面.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.已知H2S的一级和二级电离平衡常数分别为Ka(H2S)=9.1×10-8,Ka(HS-)=1.1×10-12•0.1mol•L-1的Na2S的水解程度约为52%,则有关0.1mol•L-1的Na2S溶液的说法正确的是( )
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
12.X、Y、Z、W、M均为短周期元素且原子序数依次增大,X、M同主族;Z+、W3+与Y2-具有相同的电子层结构;M 是地壳中含量占第二的元素.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 粒子半径:r(W3+)>r(Y2-)>r(Z+) | ||
| C. | MY2与Z2Y的化合物类型相同 | D. | 单质沸点:M>Z>Y |
4.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1mol SiO2中含有NA个SiO2分子 | |
| B. | 1mol Cu与足量的稀HNO3反应,转移2 NA个电子 | |
| C. | 1 LO.1mol•L-1Na2CO3 溶液中含有 0.1NA 个CO${\;}_{3}^{2-}$ | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4Na |
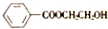 )和N(
)和N(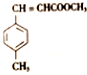 )
)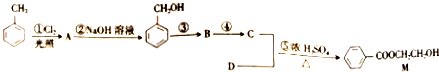
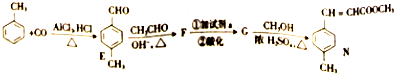
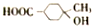 )是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).
)是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).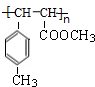 .
.




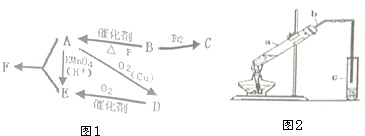 有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题:
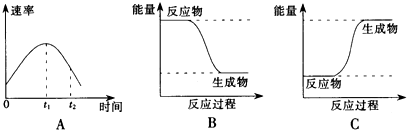
有机物A仅由C、H、O三种元素组成,一定条件下A、B、C、D、E、F之间的转化如图1所示,已知B的产量是衡量一个国家石油化工发展水平的标志.回答下列问题: 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.请回答下列问题.
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.请回答下列问题.