题目内容
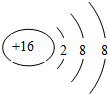
14.H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:(1)S简单离子的原子结构示意图为
 .
.(2)H2O2是实验中常用的“绿色氧化剂”,1molH218O2的中子数为20NA.
(3)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3.
(4)粉末状的Si3N4对空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在一定条件下的密闭容器中热处理,可以得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,热处理后除去固体材料中未反应的Si3N4、MgO和Mg3N2的方法是加入过量盐酸,过滤.
分析 (1)硫离子核内有16个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有8个电子,据此进行分析解答;
(2)1个H218O2的中子数为(18-8)×2=20,据此计算;
(3)根据元素非金属性越强,对应最高价含氧酸的酸性越强,所以利用强酸制弱酸的方法说明碳的非金属性强于硅;
(4)热处理后得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,而MgO、Mg(OH)2可溶于酸,故除去稳定固体材料中的Si3N4、MgO和Mg3N2可加足量稀盐酸后过滤.
解答 解:(1)硫离子核内有16个质子,核外有18个电子,分3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有8个电子,其原子结构示意图为: ,
,
故答案为: ;
;
(2)因为1个H218O2的中子数为(18-8)×2=20,所以1molH218O2的中子数为20mol=20NA,
故答案为:20NA;
(3)元素非金属性越强,对应最高价含氧酸的酸性越强,所以利用强酸制弱酸的方法说明碳的非金属性强于硅,方程式是CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,
故答案为:CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3;
(4)热处理后得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,Mg3N2与盐酸反应生成MgCl2和NH4Cl,而MgO、Mg(OH)2可溶于酸,故除去稳定固体材料中的Si3N4、MgO和Mg3N2可加足量稀盐酸后过滤,
故答案为:加入过量盐酸,过滤.
点评 本题考查了元素化合物知识,涉及离子结构、中子数计算、方程式的书写、除杂等知识,注意基础知识的积累和掌握,题目难度中等.

练习册系列答案
相关题目
1.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 0.84 g NaHCO3晶体中阳离子和阴离子总数为0.03 NA | |
| B. | a g O2和O3的混合气体中所含分子数一定为$\frac{a}{32}$NA | |
| C. | 1.8 g H2O含有的质子数为NA | |
| D. | 标准状况下,2.24 L CCl4含碳原子数为0.1 NA |
5.某同学设计aCO2(g)+bH2(g)?cCH3OH(g)+d D(g)(注:D物质未知)来生产甲醇CH3OH,为探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下:
若已知从开始到刚达平衡时用H2表示的平均反应速率是0.05mol/(L•S),平衡时CH3OH的浓度是0.05mol/L,则:
(1)则a与b的关系是?(请写出计算过程,没有计算过程不得分)
(2)请补全反应方程式
1 CO2(g)+3H2(g)?1CH3OH(g)+1H2O(g)
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
(1)则a与b的关系是?(请写出计算过程,没有计算过程不得分)
(2)请补全反应方程式
1 CO2(g)+3H2(g)?1CH3OH(g)+1H2O(g)
19.在某无色透明的溶液中,能大量共存的离子组是( )
| A. | H+、Na+、SO42-、HCO3-? | B. | Mg2+、K+、SO42-、OH- | ||
| C. | K+、Na+、Fe3+、NO3- | D. | Ba2+、OH-、NO3-、Na+ |
6.下列电离方程式正确的是( )
| A. | CaCl2=Ca2++Cl2- | B. | Ba(NO3)2=Ba+2+2NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | NaHCO3=Na++H++CO32- |
3.18O是氧的一种同位素,下列说法正确的是( )
| A. | 18O原子所含中子数为8 | |
| B. | 1mol的1H218O分子所含质子数为12个 | |
| C. | 18O2气体的摩尔体积为22.4L/mol | |
| D. | 18O2气体的摩尔质量为36g/mol |
4.CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa.
如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为( )
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa.
如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为( )
| A. | p(Br2)≤4.66×103Pa | B. | 2.33×103Pa<p(Br2)≤4.66×103Pa | ||
| C. | <p(Br2)>2.33×103Pa | D. | 2.33×103Pa≤p(Br2)≤4.66×103Pa |