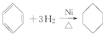题目内容
6.下列电离方程式正确的是( )| A. | CaCl2=Ca2++Cl2- | B. | Ba(NO3)2=Ba+2+2NO3- | ||
| C. | NaHSO4=Na++H++SO42- | D. | NaHCO3=Na++H++CO32- |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.方程式左边写化学式,右边写离子,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,强电解质用=连接,弱电解质用?连接.
A.氯原子角标应转化为化学计量数;
B.钡离子符号书写错误;
C.硫酸氢钠为强酸的酸式盐,完全电离;
D.HCO3-是H2CO3的酸式盐的酸根部分不能拆.
解答 解:A.氯化钙电离出氯离子和钙离子CaCl2=Ca2++2Cl-,故A错误;
B.Ba(NO3)2电离时生成钡离子、硝酸酸根离子,其电离方程式为Ba(NO3)2=Ba2++2NO3-,故B错误;
C.NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO42-离子,其电离方程式为:NaHSO4=Na++H++SO42--,故C正确;
D.NaHCO3是H2CO3的酸式盐,HCO3-不能拆,电离方程式为:NaHCO3═Na++HCO3-,故D错误;
故选C.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 11.2L NO2含氧原子数为NA | |
| B. | 标准状况下,14g CO所含质子数为7NA | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 25℃,101KPa条件下,1.4g N2的体积为1.12L |
18.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解于1L水中 | |
| B. | 10g NaOH溶解在水中配成250mL溶液 | |
| C. | 从100mL 10mol•L-1的浓盐酸中取出10mL | |
| D. | 将22.4L氯化氢气体溶于水配成1L溶液 |
16.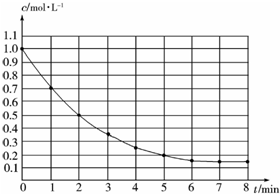 如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
 如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )| A. | X的平衡转化率为85% | |
| B. | 第6 min 后,反应就终止了 | |
| C. | 若升高温度,X的平衡转化率将大于85% | |
| D. | 若降低温度,v正减小,v逆增大 |
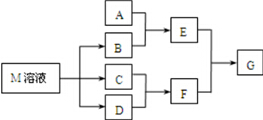 某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):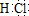 .
.
 .
.