题目内容
5.某同学设计aCO2(g)+bH2(g)?cCH3OH(g)+d D(g)(注:D物质未知)来生产甲醇CH3OH,为探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
(1)则a与b的关系是?(请写出计算过程,没有计算过程不得分)
(2)请补全反应方程式
1 CO2(g)+3H2(g)?1CH3OH(g)+1H2O(g)
分析 (1)3s时处于平衡状态,平衡时消耗的二氧化碳为0.1mol,消耗的氢气为0.05mol/(L•S)×3s×2L=0.3mol,物质的量之比等于化学计量数之比;
(2)平衡时生成甲醇为0.05mol/L×2L=0.1mol,物质的量之比等于化学计量数之比,则a:b:c=0.1:0.3:0.1=1:3:1,由元素守恒可知,D中不含碳元素,含有H、O元素,且D分子中H、O原子数目之比为(6-4):(2-1)=2:1,故D为H2O.
解答 解:(1)3s时处于平衡状态,平衡时消耗的二氧化碳为0.4mol-0.3mol=0.1mol,消耗的氢气为0.05mol/(L•S)×3s×2L=0.3mol,物质的量之比等于化学计量数之比,则a:b=0.1:0.3,故b=3a,
答:a与b的关系是b=3a;
(2)平衡时生成甲醇为0.05mol/L×2L=0.1mol,物质的量之比等于化学计量数之比,则a:b:c=0.1:0.3:0.1=1:3:1,由元素守恒可知,D中不含碳元素,含有H、O元素,且D分子中H、O原子数目之比为(6-4):(2-1)=2:1,故D为H2O,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
故答案为:1;3;1;1H2O.
点评 本题考查化学平衡计算、化学方程式配平,难度不大,(2)中注意质量守恒定律的应用,有利于基础知识的巩固.

练习册系列答案
相关题目
12.下列操作不属于混合物分离的是( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 搅拌 |
10.已知反应:2CH3OH(g)?CH3OCH3(g)+H2O(g),某温度下的平衡常数为400.在此温度下,向密闭容器中加入一定量CH3OH,反应到5min时测得各组分的浓度如表所示:
(1)该反应在低温下(此时水为液态)能自发进行,则该反应的△H<0 (填“>”、“<”或“=”,下同).
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
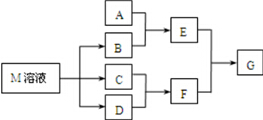 某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):
某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如下图所示(部分产物已去):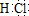 .
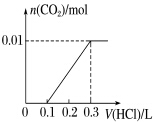
.
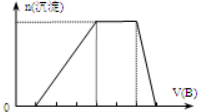
 、
、 ;
; 、
、 .
. .
.