题目内容
2.某研究小组以粗盐和碳酸氢铵(NH4HC03)为原料,采用以下流程制备纯碱(Na2C03)和氯化铵(NH4Cl).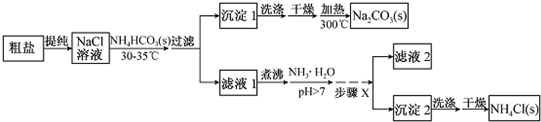
已知盐的热分解温度:NH4HCO336℃,NaHCO3270℃,NH4Cl340℃,Na2CO3>850℃
请回答:
(1)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HC03固体之后,其原因是可避免NH4HCO3的分解.
(2)为提高NH4Cl产品的产率和纯度,需在滤液1中加入氨水,理由是抑制NH4+水解、使NaHCO3转化为Na2CO3、补充煮沸时损失的NH3;步骤X包括的操作有蒸发浓缩、冷却结晶、过滤.
(3)测定NH4Cl产品的纯度时,可采用的方法:在NH4Cl溶液中加入甲醛使之生成游离酸,然后以酚酞为指示剂,用NaOH标准溶液(需用邻苯二甲酸氢钾基准物标定)进行滴定.
①下列有关说法正确的是BD.
A.为了减少滴定误差,滴定管、锥形瓶均须用待装液润洗
B.标准NaOH溶液可以装入带有耐腐蚀旋塞的玻璃滴定管中
C.开始滴定前,不需擦去滴定管尖悬挂的液滴
D.三次平行测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置
②若用来标定NaOH标准溶液的邻苯二甲酸氢钾基准物使用前未烘至恒重,则测得NH4Cl产品的含量比实际含量偏大(填“偏大”、“偏小”或“无影响”)
分析 根据题中流程可知,粗盐水提纯后得氯化钠溶液,经蒸发浓缩后,温度控制在30℃~35℃,防止碳酸氢按分解,加入碳酸氢铵,生成沉淀1为碳酸氢钠,滤液1主要为氯化铵,氯化铵溶液中加入氨水,可抑制铵根离子的水解,经过蒸发浓缩、冷却结晶、过滤可得沉淀2为氯化铵固体,经洗涤、干燥得纯净的氯化铵,滤液2中含有少量的氯化铵和碳酸氢钠,
(1)蒸发浓缩时溶液要加热,而NH4HCO3在36℃开始分解,据此答题;
(2)氨水能抑制铵根离子的水解,同时能使NaHCO3转化为Na2CO3,并补充煮沸时损失的NH3,从氯化铵溶液得到氯化铵固体可以通过蒸发浓缩,冷却结晶,过滤的方法;
(3)①滴定操作过程中,滴定前,滴定管必须检漏和润洗,而锥形瓶只能水洗,滴定时碱溶液只能盛装在碱式滴定管里,并且滴定管尖嘴上悬挂的液滴要除掉,否则会影响滴定结果,调整液面时每次均需调至“0”刻度或“0”刻度以下的附近位置;
②用来标定NaOH标准溶液的邻苯二甲酸氢钾基准物使用前未烘至恒重,则标定NaOH标准溶液的浓度偏高,再用NaOH标准溶液滴定时,虽消耗的标准液体积不变,但仍导致NH4Cl产品的含量产生误差.
解答 解:(1)蒸发浓缩时溶液要加热,而NH4HCO3在36℃开始分解,所以在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是可避免NH4HCO3的分解,故答案为:可避免NH4HCO3的分解;
(2)氨水能抑制铵根离子的水解,同时能使NaHCO3转化为Na2CO3,并补充煮沸时损失的NH3,从氯化铵溶液得到氯化铵固体可以通过蒸发浓缩,冷却结晶,过滤的方法,
故答案为:抑制NH4+水解、使NaHCO3转化为Na2CO3、补充煮沸时损失的NH3;蒸发浓缩、冷却结晶、过滤;
(3)①A.为了减少滴定误差,滴定管须用待装液润洗,锥形瓶不必润洗,A错误;
B.因其腐蚀性强,标准NaOH溶液装入碱式滴定管或带有耐腐蚀旋塞的玻璃滴定管中,B正确;
C.开始滴定前,滴定管尖悬挂的液滴需除掉,C错误;
D.测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置,D正确;
故答案为:BD;
②邻苯二甲酸氢钾基准物使用前未烘至恒重,则标定的NaOH标准溶液的浓度偏高,再用NaOH标准溶液滴定时,消耗的体积不变,根据酸碱滴定原理,仍导致NH4Cl产品的含量比实际含量偏大.
点评 本题考查侯氏制碱法、溶解度、物质的分离提纯、物质含量测定等,难度中等,侧重考查学生对流程的分析和基础知识的灵活的应用.

| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ca2+、HCO3-、NH4+、AlO2- | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Na+、NH4+、SO42-、K+ |
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在下图装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O

(1)图1反应装置中加入沸石的目的是防止暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.
(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
| A. | 11.2L NO2含氧原子数为NA | |
| B. | 标准状况下,14g CO所含质子数为7NA | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 25℃,101KPa条件下,1.4g N2的体积为1.12L |
 .
.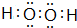 ;YW2分子形状为直线形.
;YW2分子形状为直线形.