题目内容
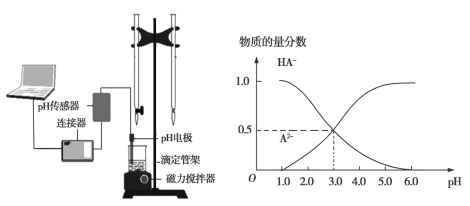
【题目】室温下,用0.1mol/L氨水分别滴定20.0mL 0.1mol/L的盐酸和醋酸,曲线如图所示,下列叙述中不正确的是
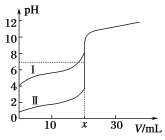
A. x=20
B. Ⅰ曲线表示的是滴定醋酸的曲线
C. 滴定过程中![]() 的值逐渐减小
的值逐渐减小
D. 当Ⅰ曲线和Ⅱ曲线pH均为7时,某一溶液中的c(Cl-)大于另一溶液中的c(CH3COO-)
【答案】A
【解析】
A.滴入x mL氨水时,盐酸的pH达到7,如果恰好完全中和生成氯化铵,氯化铵溶液的pH小于7,所以必然有氨水过量,x>20,故A选;
B.盐酸的初始pH为1,所以Ⅱ是盐酸,Ⅰ是醋酸,故B不选;
C.把![]() 的分子和分母都乘以c(OH-),即
的分子和分母都乘以c(OH-),即![]() ,随着氨水的不断滴入,c(OH-)不断增大,所以
,随着氨水的不断滴入,c(OH-)不断增大,所以![]() 的值逐渐减小,故C不选;
的值逐渐减小,故C不选;
D. 当Ⅰ曲线和Ⅱ曲线pH均为7时,盐酸中加入的氨水大于醋酸中加入的氨水,根据电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-)和c(NH4+)+c(H+)=c(OH-)+c(CH3COO-),常温下,pH=7的溶液是中性的,c(H+)=c(OH-),由于盐酸中的c(NH4+)大于醋酸中的c(NH4+),所以盐酸中的c(Cl-)大于醋酸溶液中的c(CH3COO-),故D不选;
故选A。

 习题精选系列答案
习题精选系列答案【题目】现有甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL 5%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
甲、乙两小组得出如图数据:
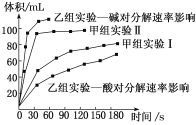
关于该实验下列叙述不正确的是
A. 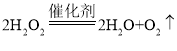 中,O2是氧化产物
中,O2是氧化产物
B. 甲小组实验得出的结论是Fe2O3比MnO2催化效率更高
C. 甲小组实验也可以测定25℃时,在相同时间内产生氧气的体积
D. 乙组研究的影响因素的数据分析,相同条件下H2O2在碱性环境下放出气体速率较快