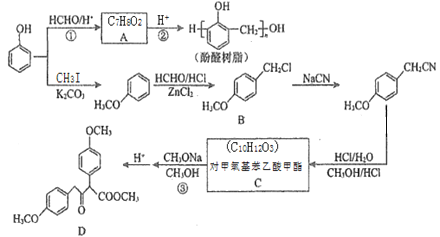
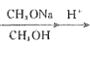题目内容
【题目】按要求完成下列各小题。
(1)等浓度的三种溶液①NH4HCO3、② NH4Cl、③NH4HSO4,则c(NH4+)由大到小排列的顺序为____(填序号)。
(2)常温下,将0.1 mol·L-1的HCN溶液和0.1 mol·L-1的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH____7,c(HCN)+c(CN-)_____0.1 mol·L-1,c(HCN)-c(CN-)_____2c(OH-)(填“>”,“<”或“=”)。
(3)小苏打溶液显碱性而不是显酸性的原因:________,溶液中离子浓度大小顺序:___________。
(4)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述________装置(填装置序号)原理进行防护;装置③中总反应的离子方程式为____________________。检验石墨电极产物气体的方法:_________________________。
【答案】③>②>① > = < HCO3- 的水解程度大于电离程度 c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) ②③ 2Cl- + 2H2O ![]() 2OH- + H↑ + Cl↑ 用湿润的淀粉KI试纸靠近电极附近,若试纸变蓝,则说明有Cl2
2OH- + H↑ + Cl↑ 用湿润的淀粉KI试纸靠近电极附近,若试纸变蓝,则说明有Cl2
【解析】
(1)①NH4HCO3②NH4Cl③NH4HSO4中,溶液中c(NH4+)根据盐类水解的影响分析判断;
(2)常温下,等物质的量浓度、等体积的NaCN、HCN混合,混合溶液中c(HCN)>c(CN-),说明HCN电离程度小于CN-水解程度,溶液呈碱性;混合溶液中存在物料守恒、质子守恒,根据物料守恒、质子守恒解答问题;
(3) 小苏打溶液中存在HCO3-的电离和水解,溶液显碱性而不是显酸性说明HCO3- 的水解程度大于电离程度;结合电荷守恒物料守恒及水的电离比较离子浓度大小;
(4) ①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护。
(1) 物质的量浓度相同的下列溶液:①NH4HCO3②NH4Cl③NH4HSO4,①NH4HCO3中NH4+水解显酸性,HCO3-水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,
②NH4Cl中铵根离子的水解既没被促进也没被抑制,③NH4HSO4中氢离子对铵根离子的水解有抑制作用,铵根离子水解程度变小,即溶液中c(NH4+)③>②>①;
因此,本题正确答案是:③>②>①;
(2) 常温下,等物质的量浓度、等体积的NaCN、HCN混合,混合溶液中c(HCN)>c(CN-),说明HCN电离程度小于CN-水解程度,溶液呈碱性,则pH>7;混合溶液中存在物料守恒,混合溶液体积增大一倍,所以物质浓度降为原来的一半,根据物料守恒得c(HCN)+c(CN-)=0.1 mol·L-1;
根据质子守恒得2c(H+)+c(HCN)=2c(OH-)+ c(CN-),则c(HCN)-c(CN-)=2c(OH-)- 2c(H+)<2c(OH-),
因此,本题正确答案是:>;=;<;
(3) 小苏打溶液中存在HCO3-的电离和水解,溶液显碱性而不是显酸性说明HCO3- 的水解程度大于电离程度;小苏打溶液显碱性,则c(OH-)>c(H+), HCO3-水解生成H2CO3,HCO3-电离生成CO32-,水解程度不大,由物料守恒可以知道存在c(Na+)= c(H2CO3)+c(HCO3-)+c(CO32-),则离子浓度为c(Na+)>c(HCO3-)>c(CO32-),HCO3-离子水解均生成OH-,且水电离生成OH-,
则此时溶液中离子浓度大小顺序是c(Na+)>c(HCO3--)>c(OH)-)>c(H+)>c(CO32-),
因此,本题正确答案是:c(Na+)>c(HCO3--)>c(OH)-)>c(H+)>c(CO32-);
(4)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;②③装置中铁被保护,但装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,反应离子方程式为:2Cl- + 2HO == 2OH- + H↑ + Cl↑,检验氯气的方法是:用湿润的淀粉KI试纸靠近电极附近,若试纸变蓝,则说明有Cl2,
因此,本题正确答案是:②③; 2Cl- + 2HO == 2OH- + H↑ + Cl↑;用湿润的淀粉KI试纸靠近电极附近,若试纸变蓝,则说明有Cl2。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案