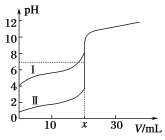
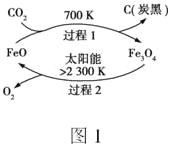
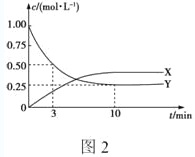
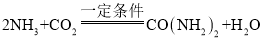题目内容
【题目】把2.7 g铝投入100 mL 3 mol·L-1的NaOH溶液中充分反应后,再滴入1 mol·L-1的盐酸溶液400 mL,其结果错误的是
A. 溶液显酸性B. 得到澄清透明溶液
C. 得到浑浊溶液D. 溶液中铝元素有两种微粒存在形式
【答案】B
【解析】
铝与NaOH发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,2.7gAl的物质的量为![]() =0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,显然NaOH过量,然后求出生成NaAlO2的量,滴入盐酸,发生NaOH+HCl=NaCl+H2O,然后再根据量进行分析。
=0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,显然NaOH过量,然后求出生成NaAlO2的量,滴入盐酸,发生NaOH+HCl=NaCl+H2O,然后再根据量进行分析。
2.7gAl的物质的量为![]() =0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,铝与NaOH发生反应:
=0.1mol,n(NaOH)=100×10-3L×3mol·L-1=0.3mol,铝与NaOH发生反应:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
0.1 0.3
氢氧化钠过量,剩余NaOH的量为0.2mol,产生NaAlO2的量为0.1mol,滴加盐酸,n(HCl)=400×10-3L×1mol·L-1=0.4mol,
发生NaOH+HCl=NaCl+H2O,
0.2 0.2
剩余HCl的物质的量0.2mol,然后发生AlO2-+H++H2O=Al(OH)3↓,
0.1 0.2 0.1
然后发生Al(OH)3+3H+=Al3++3H2O,
0.1 0.1
盐酸不足,完全反应,氢氧化铝还有剩余,
A、根据上述分析,溶液中有AlCl3,AlCl3为强酸弱碱盐,溶液显酸性,故A说法正确;
B、根据上述分析,氢氧化铝还有剩余,得到浑浊溶液,故B说法错误;
C、根据B选项分析,故C说法正确;
D、铝元素存在Al(OH)3和Al3+两种形式,故D说法正确;
答案为B。

【题目】写出下列有机物的系统命名或结构简式:
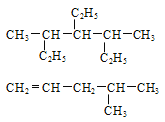
(1)_____________
(2)_____________
(3)4,4,5-三甲基-2-己炔 _______________
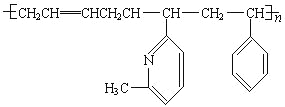
(4)新型弹性材料“丁苯吡橡胶”的结构简式如下:其单体为______________(有几种写几种)
(5)如下表所示,为提纯下列物质(括号内为少量杂质),填写所选用的除杂试剂与主要分离方法
不纯物质 | 除杂试剂 | 分离方法 | |
1 | 溴苯(Br2) | __________ | __________ |
2 | 乙醛(乙酸) | __________ | __________ |
3 | 乙酸乙酯(乙酸) | __________ | __________ |
4 | 乙醇(苯酚) | __________ | __________ |
5 | 硝基苯(硝酸) | __________ | __________ |
(6)①C5H12O的醇,在一定条件下能发生催化氧化反应,产物能与新制的氢氧化铜反应生成红色沉淀,醇的核磁共振氢谱中有三组峰,写出满足上述条件的醇的结构简式______
②C5H12O的醇,在一定条件下不能发生消去反应,写出满足条件的醇的结构简式______
③分子式为C5H12O,不能与金属钠反应.核磁共振氢谱中有四组峰,峰的面积比为3:2:1:6,写出满足上述条件的物质的结构简式______.