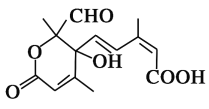
题目内容
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30 mL 0.1 mol·L1 H2A溶液中逐滴加入等浓度NaOH溶液时pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是

A. pH=4.0时,溶液中n(HA)约为2.73×104 mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1 mol·L1NaHA溶液中存在c(A2)+c(HA)+c(H2A)=0.1 mol·L1
【答案】D
【解析】
由图可知pH=3时,溶液中不存在H2A,说明H2A第一步完全电离,第二步部分电离。pH=3时A2-、HA-的物质的量分数相等,所以二者的浓度相等,则Ka2=![]() =c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,据此计算n(HA-);本实验是碱滴定酸,酸式滴定管用来盛放酸,碱式滴定管用来盛放碱;由图可知,pH=3时,溶液中c(A2-)=c(HA-);该二元酸第一步完全电离,第二步部分电离,所以NaHA溶液中不存在H2A。
=c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,据此计算n(HA-);本实验是碱滴定酸,酸式滴定管用来盛放酸,碱式滴定管用来盛放碱;由图可知,pH=3时,溶液中c(A2-)=c(HA-);该二元酸第一步完全电离,第二步部分电离,所以NaHA溶液中不存在H2A。
由图可知H2A第一步完全电离,第二步部分电离。pH=3时A2-、HA-的物质的量分数相等,所以二者的浓度相等,则Ka2=![]() =c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,解得溶液中n(HA)约为2.73×104 mol,A正确;碱滴定酸,碱不能盛放在左边的酸式滴定管中,应该使用右边的碱式滴定管,B正确;由图可知,pH=3时,溶液中c(A2-)=c(HA-),则等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0,C正确;该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2-)+c(HA-)=0.1mol/L,D错误。
=c(H+)=0.001mol/L,同一溶液中HA-和A2-的物质的量浓度之比等于物质的量之比,pH=4时该酸的第二步电离常数不变,则由n(A2-)=10n(HA-),且原溶液中n(HA-)+n(A2-)=0.003mol,解得溶液中n(HA)约为2.73×104 mol,A正确;碱滴定酸,碱不能盛放在左边的酸式滴定管中,应该使用右边的碱式滴定管,B正确;由图可知,pH=3时,溶液中c(A2-)=c(HA-),则等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0,C正确;该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2-)+c(HA-)=0.1mol/L,D错误。
故选D。