题目内容
9.下列各溶液中,微粒的物质的量浓度关系错误的是( )| A. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)<c( Cl-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| D. | NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
分析 A.氯化铵溶液中,铵根离子部分水解,导致铵根离子浓度减小;
B.混合液为酸性,则c(H+)>c(OH-),结合电荷守恒可知:c(CH3COO-)>c(Na+);
C.根据碳酸钠溶液中的物料守恒判断;
D.根据碳酸氢钠溶液中的电荷守恒判断.
解答 解:A.0.1 mol•L-1 NH4Cl溶液中,铵根离子部分水解,则氯离子浓度大于铵根离子,即:c(NH4+)<c( Cl-),故A正确;
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,则c(H+)>c(OH-),结合电荷守恒可知:c(CH3COO-)>c(Na+),所以溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.0.1 mol•L-1 Na2CO3溶液,根据物料守恒可得:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故C正确;
D.根据碳酸氢钠溶液中的电荷守恒可知:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
6.在一定温度下H2(g)+I2(g)?2HI(g),达到化学平衡状态的标志是( )
| A. | H2、I2、HI共存 | |
| B. | 单位时间内生成n mol H2,同时生成n mol I2 | |
| C. | 单位时间内生成2n mol HI,同时生成n mol I2 | |
| D. | H2、I2、HI的 物质的量浓度比为1:1:2 |
4.已知热化学方程式:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②H2(g)=$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
据此判断下列说法正确的是( )
②H2(g)=$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
据此判断下列说法正确的是( )
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
4.核磁共振氢谱(1HNMR)是研究有机物分子结构的方法之一,每个有机物分子结构中的氢原子在1HNMR上都给出了相应的红外吸收峰(信号),每种峰的强度与结构中的氢原个子数成正比.则乙醇(CH3CH2OH)分了在1HNMR中的信号和强度分别是( )
| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
18.下列各分子式只表示一种物质的是( )
| A. | CH2Br2 | B. | C3H7Cl | C. | C4H10 | D. | C |
19.下列关于①苯②乙醇③乙酸④葡萄糖等有机物的叙述中,不正确的是( )
| A. | 可以用新制氢氧化铜鉴别③与④ | B. | ①、②、③均能与金属钠反应 | ||
| C. | ①、②、③均能发生取代反应 | D. | 一定条件下,④可以转化为② |
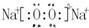 ;
;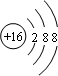 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为: .AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.
.AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.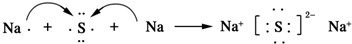 .该化合物属于离子(填“共价”或“离子”)化合物.
.该化合物属于离子(填“共价”或“离子”)化合物.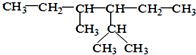 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷.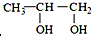 <
< 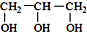 (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)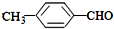 <
<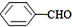
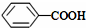 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)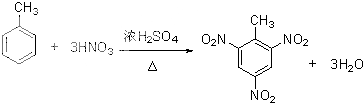 ;
;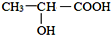 )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: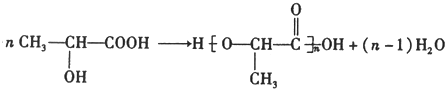 .
.