题目内容
7.下列六种物质中①Ar ②CO2 ③NH4Cl ④KOH ⑤Na2O2 ⑥MgCl2 请回答:(1)只存在共价键的是②;(填写序号)只存在离子键的是⑥;(填写序号)不存在化学键的是①.(填写序号)
(2)Na2O2的电子式为
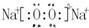 ;
;(3)KOH溶于水,破坏了离子键;氯化铵受热分解破坏了离子键,共价键.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,以此解答该题.
解答 解:(1)只存在共价键为共价化合物或非金属单质,二氧化碳符合,MgCl2为离子化合物,只存在离子键,而Ar为单原子分子,不存在共价键,
故答案为:②; ⑥; ①;
(2)Na2O2为离子化合物,电子式为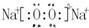 ,故答案为:
,故答案为: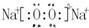 ;
;
(3)KOH为离子化合物,含有离子键和共价键,溶于水破坏离子键,氯化铵为离子化合物,加热分解破坏离子键和共价键,故答案为:离子键;离子键,共价键.
点评 本题考查了化学键的判断和电子式的书写,为高频考点,明确共价键和离子键的区别及电子式书写规则即可解答,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
17.基态原子的核外电子在原子轨道上的能量大小关系不正确的是( )
| A. | 3s>2s | B. | 3p>3s | C. | 4s>3d | D. | 3d>3s |
18.某元素X的气态氢化物的分子式为H2X,则X的最高价含氧酸的分子式为( )
| A. | H2XO3 | B. | H2XO4 | C. | HXO3 | D. | HXO4 |
15.在10L容器中进行如下反应:N2+3H2?2NH3,3秒钟后,NH3的物质的量增加0.12mol,用H2浓度的变化表示3秒钟内的平均反应速率为( )
| A. | 0.009 mol/(L•s) | B. | 0.006mol/(L•s) | C. | 0.045mol/(L•s) | D. | 0.003mol/(L•s) |
2.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
19.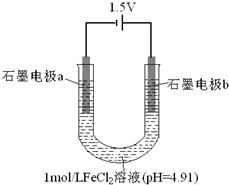 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
9.下列各溶液中,微粒的物质的量浓度关系错误的是( )
| A. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)<c( Cl-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| D. | NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
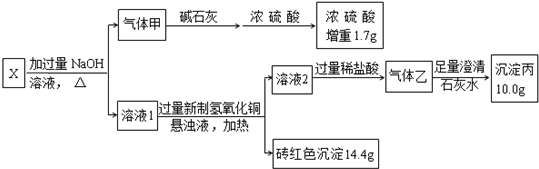
 ,写出气体甲的电子式
,写出气体甲的电子式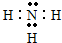 .
.