题目内容
4.已知热化学方程式:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1②H2(g)=$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
据此判断下列说法正确的是( )
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
分析 A、放热越多△H越小;
B、燃烧热中H生成液态水;
C、据已知反应,利用盖斯定律②-①得一热化学方程式;
D、据已知方程式,①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1据盖斯定律,①-②进行计算.
解答 解:A、生成液态水比生成水蒸气放热多,放热越多焓变越小,H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H<-241.8 kJ•mol-1,故A错误;
B、H的燃烧热必须是生成液态水时放出的热量,所以氢气的燃烧热数值应大于241.8 kJ•mol-1,故B错误;
C、已知热化学方程式:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,据盖斯定律,②-①得:H2(g)+CO2(g)=H2O(g)+CO(g)△H=+41.2KJ/mol,所以H2(g)转变成H2O(g)的化学反应也可以吸热,故C错误;
D、已知热化学方程式:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1据盖斯定律,①-②得:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ•mol-1,故D正确;
故选D.
点评 本题考查了盖斯定律、燃烧热、放热越多焓变越小,注意放热反应的焓变小于0,题目难度不大.

练习册系列答案
相关题目
15.在10L容器中进行如下反应:N2+3H2?2NH3,3秒钟后,NH3的物质的量增加0.12mol,用H2浓度的变化表示3秒钟内的平均反应速率为( )
| A. | 0.009 mol/(L•s) | B. | 0.006mol/(L•s) | C. | 0.045mol/(L•s) | D. | 0.003mol/(L•s) |
19.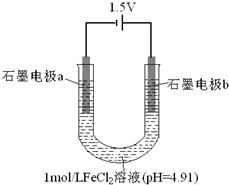 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
2.下列分子式中只表示一种分子的是( )
| A. | C3H6 | B. | C2H6O | C. | C3H8 | D. | C3H6O2 |
9.下列各溶液中,微粒的物质的量浓度关系错误的是( )
| A. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)<c( Cl-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| D. | NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
6.同温同压下,下列各反应均为放热反应,则各热化学方程式中Q数值最小的是( )
| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
7.元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质与水剧烈反应产生氧气.则下列判断不正确的是( )
| R | ||
| X | T | Z |
| Q |
| A. | 非金属性:X<T<Z | B. | R和Q的电子数差为26 | ||
| C. | 气态氢化物稳定性:R<T<Z | D. | 最高价含氧酸酸性:T>Q |
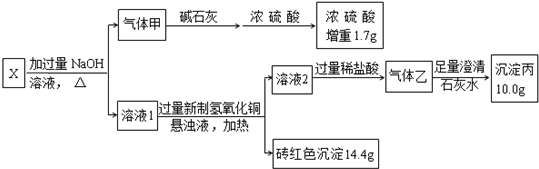
 ,写出气体甲的电子式
,写出气体甲的电子式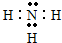 .
.