题目内容
4.核磁共振氢谱(1HNMR)是研究有机物分子结构的方法之一,每个有机物分子结构中的氢原子在1HNMR上都给出了相应的红外吸收峰(信号),每种峰的强度与结构中的氢原个子数成正比.则乙醇(CH3CH2OH)分了在1HNMR中的信号和强度分别是( )| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
分析 有几种氢原子就有几个峰,峰的强度与结构中的H原子数成正比,据此解答即可.
解答 解:CH3CH2OH中有3种氢原子,氢原子个数比为3:2:1.故选B.
点评 本题考查核磁共振氢谱,难度不大,注意核磁共振氢谱中有几种氢原子就有几个峰,峰的强度与结构中的H原子数成正比.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1.下列溶液肯定呈酸性的是( )
| A. | 含有 H+离子的溶液 | B. | 酚酞显无色的溶液 | ||
| C. | c(OH-)<c(H+)的溶液 | D. | pH 小于 7 的溶液 |
2.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
19.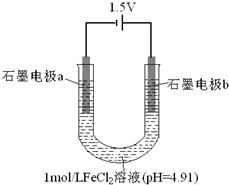 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
6.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表一所示;
②不同离子沉淀的pH如图2所示.
(1)步骤I中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量.
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;K甲[Y2(C2O4)3]=8.0×10-28
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
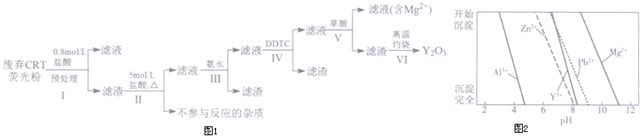
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表一所示;
②不同离子沉淀的pH如图2所示.
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;K甲[Y2(C2O4)3]=8.0×10-28
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.

9.下列各溶液中,微粒的物质的量浓度关系错误的是( )
| A. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)<c( Cl-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| D. | NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
16.(1)由Zn-Cu-硫酸溶液组成的原电池,工作一段时间后,锌片的质量减少了6.5g.回答下列问题:
①上述原电池的正极是:Cu,电极反应式:2H++2e-=H2↑.
②若将电解质溶液改为硫酸铜溶液,负极是:Zn,负极电极反应式:Zn-2e-=Zn2+;正极电极反应式:Cu2++2e-═Cu.当电池输出相同的电量时,电池两极的质量差为12.9g.
(2)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中负极的电极反应式是:A-2e-═A2+.
②装置乙中正极的电极反应式是:Cu2++2e-═Cu.
③装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
①上述原电池的正极是:Cu,电极反应式:2H++2e-=H2↑.
②若将电解质溶液改为硫酸铜溶液,负极是:Zn,负极电极反应式:Zn-2e-=Zn2+;正极电极反应式:Cu2++2e-═Cu.当电池输出相同的电量时,电池两极的质量差为12.9g.
(2)由A、B、C、D四种金属按下表中装置进行实验.
| 装置 | 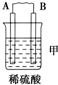 | 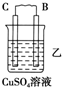 | 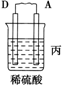 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极的电极反应式是:A-2e-═A2+.
②装置乙中正极的电极反应式是:Cu2++2e-═Cu.
③装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
13.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)从上表可推断,反应①是吸热(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3平衡常数为K3
a.根据反应①与②推导出K1、K2、K3的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$;可推断反应③是吸(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有BD.
A.缩小容器体积 B.升高温度 C.使用合适的催化剂 D.设法减少CO的量 E.降低温度
b.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=Q1-Q2.
| 温度( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(2)现有反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3平衡常数为K3
a.根据反应①与②推导出K1、K2、K3的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$;可推断反应③是吸(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有BD.
A.缩小容器体积 B.升高温度 C.使用合适的催化剂 D.设法减少CO的量 E.降低温度
b.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=Q1-Q2.
14.下列关于原子结构、元素性质的说法正确的是( )
| A. | ⅠA族金属元素是同周期中金属性最强的元素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |