题目内容
8.(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如图1:①该反应的热化学方程式为
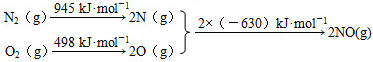 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.②根据图1所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数KAC.
A.可能增大 B.一定不变 C.可能不变 D.可能减小 E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g)?H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l)?H2O(g)+H2NCONH2(l)
某实验小组模拟工业上合成尿素的条件,在一体积为500L的密闭容器中投入4mol氨和1mol二氧化碳,验测得
反应中各组分的物质的量随时间的变化如图2所示:
①合成尿素总反应的快慢由第二步反应决定.
②反应进行到10min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)=1.5×10-4mol/(L•min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:a.氨基甲酸铵浓度先增大,15min后减小;b15min时第一步反应达到平衡状态,55min第二步反应达到平衡状态.

分析 (1)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②平衡向正反应方向移动,则N2的转化率增大,可采用的方法为升高温度或者增加氧气的量;
(2)①已知总反应的快慢由慢的一步决定,结合图象变化趋势进行判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②分析图象计算10分钟时二氧化碳的消耗物质的量,结合化学反应速率概念进行计算;
③分析图象曲线的变化,氨基甲酸铵是随时间变化到15min物质的量增大,之后减小,15min时第一步反应达到平衡状态,55min氨基甲酸铵物质的量不再变化,第二步反应达到平衡状态.
解答 解:(1)①该反应中的反应热=反应物的键能和-生成物的键能和=(946+498)kJ/mol-2×630kJ/mol=+184kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
②只改变条件R,当N2的转化率从a3到a1时,平衡向正反应方向移动,则N2的转化率增大,可采用的方法为升高温度K增大或者增加氧气的量K不变,故选:A、C;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化,发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,已知总反应的快慢由慢的一步决定,故合成尿素总反应的快慢由第二步决定,
故答案为:二;
②依据图象分析,二氧化碳再进行到10min时物质的量为0.25mol,所以此时的反应速率为=$\frac{\frac{1mol-0.25mol}{500L}}{10min}$=1.5×10-4mol/(L•min),
故答案为:1.5×10-4;
③分析图象曲线的变化,氨基甲酸铵物质的量随时间变化,到15min物质的量最大,之后减小,上图中氨气物质的量不变,15min时第一步反应达到平衡状态,55min氨基甲酸铵物质的量不再变化,第二步反应达到平衡状态;
故答案为:氨基甲酸铵浓度先增大,15min后减小;15min时第一步反应达到平衡状态,55min第二步反应达到平衡状态.
点评 本题考查了热化学方程式的计算分析,化学反应速率、平衡常数和化学平衡状态的分析判断,主要是图象变化的分析应用,掌握基础是解题关键,题目难度中等.

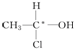 等,下列化合物中存在对映异构体的是( )
等,下列化合物中存在对映异构体的是( )| A. | 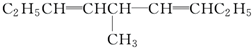 | B. | 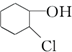 | ||
| C. | 甲酸 | D. | C6H5CH2OCH3 |
| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
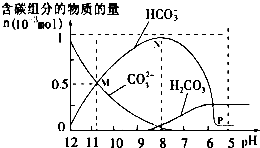 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | HCl溶液滴加一半时,溶液pH>7 | |
| B. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
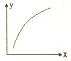 MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( ) | 选项 | x | y |
| A | CO的物质的量 | CO与CO的物质的量之比 |
| B | SO的浓度 | 平衡常数K |
| C | 温度 | 容器内混合气体的密度 |
| D | CO的浓度 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol/L的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
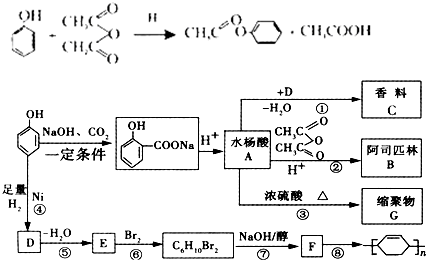
 .
. ;
;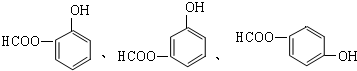 .
. .
.